题目内容
17.工业制备氯化铜时,将浓盐酸加热至80℃左右,慢慢加入粗CuO粉末(含杂质Fe2O3、FeO),充分搅拌,使之溶解,得一强酸性的混合溶液,现欲从该混合溶液中制备纯净的CuCl2溶液,采用以下步骤[参考数据:pH≥9.6时,Fe2+完全水解成Fe(OH)2;pH≥6.4时,Cu2+完全水解成Cu(OH)2;pH≥3.7时,Fe3+完全水解成Fe(OH)3].请回答以下问题:(1)第一步,如果直接调整pH=9.6,不能将Cu2+和Fe2+分离除去,理由是:Cu2+也被完全沉淀了.现有下列几种常用的氧化剂,可用于氧化除去混合溶液中Fe2+,其中最好选:②.
①KMnO4 ②H2O2 ③NaClO ④浓HNO3
(2)除去溶液中Fe3+的方法是调整溶液的pH=3.7,现有下列试剂均可以使强酸性溶液的pH调整到3.7,可选用的有①③.
①Cu(OH)2 ②氨水 ③Cu2(OH)2CO3 ④NaOH
(3)直接加热溶液,蒸干不能(选填“能”或“不能”)得到氯化铜晶体(CuCl2•2H2O).
分析 (1)除去Fe2+时,应避免Cu2+生成沉淀;加入氧化剂时,不能引入新的杂质;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质;
(3)铜离子水解生成盐酸易挥发,不能得到氯化铜.
解答 解:(1)由题给信息可知,除去Fe2+时,应避免Cu2+生成沉淀,如直接调整溶液pH=9.6,则生成氢氧化亚铁的同时,氢氧化铜、氢氧化铁也同时生成;加入氧化剂时,不能引入新的杂质,如用NaClO,则可引入NaCl杂质,浓硝酸、高锰酸钾的还原产物均引入新杂质,应加入过氧化氢,故答案为:Cu2+也被完全沉淀了;②;
(2)使Fe3+转化为Fe(OH)3沉淀,应调节溶液的pH,所加物质能与酸反应,注意不能引入新杂质,氨水、NaOH均引入新杂质,则可用CuO 或Cu(OH)2或CuCO3;
故答案为:①③;
(3)加热促进铜离子水解,铜离子水解生成盐酸易挥发,不能得到氯化铜,故答案为:不能.
点评 本题考查较为综合,涉及物质的分离、提纯和制备,侧重于学生的分析能力和实验能力的考查,注意把握物质的性质以及题给信息,题目难度不大.

练习册系列答案
相关题目
8.下列有关氯气的说法正确的是( )
| A. | 氯气是黄绿色气体,有毒,有刺激性气味,氯水还可杀菌消毒 | |
| B. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| C. | 红热的铁丝在Cl2中燃烧产生棕色的雾;H2在Cl2中燃烧火焰呈淡蓝色 | |
| D. | 氯水长时间放置会变质,是因为氯气几乎完全挥发,剩下的就是水. |
12.下表列出了①~⑨九种元素在周期表中的位置:
请按要求回答下列问题.
(1)化学性质最不活泼的元素的原子结构示意图为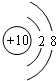
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程: .
.
| ⅠA | Ⅷ | ||||||
| ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| ② | ③ | ④ | ⑧ | ||||
| ⑤ | ⑥ | ⑦ | ⑨ | ||||
(1)化学性质最不活泼的元素的原子结构示意图为
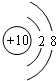
(2)⑥④⑦的氢化物的稳定性最强的是:H2O(写氢化物的化学式);
(3)元素③④⑤形成的离子半径由大到小的顺序是N3->O2->Na+(用离子符号表示)
(4)用电子式表示元素⑤与⑦的化合物的形成过程:
 .
.
2.NaHCO3俗名小苏打,下面是对NaHCO3采用不同分类法的分类,正确的是( )
| A. | NaHCO3是碱 | B. | NaHCO3是正盐 | C. | NaHCO3是强酸盐 | D. | NaHCO3是酸式盐 |
9.25℃,pH=2的 HC1溶液中,由水电离出的c(H+)是( )
| A. | 1×10-7 mol/L | B. | 1×10-12mol/L | C. | 1×10-2 mol/L | D. | 1×10-7 mol/L |
6.下列反应中,生成物的总能量大于反应物总能量的是( )
| A. | 氢气在氧气中燃烧 | B. | 氢气与氯气化合 | ||
| C. | 中和反应 | D. | 焦炭在高温下与水蒸气反应 |
7.X、Y、Z、W是原子序数依次增大的四种短周期元素,甲?乙?丙?戊是由其中的两种或三种元素组成的化合物,丁是由Z元素形成的单质.已知:甲+丙→丁+己,甲+乙→戊+丁;25℃时0.01mol•L-1己溶液的pH为12.下列说法不正确的是( )
| A. | 1.0L 0.1mol•L-1戊溶液中阴离子总的物质的量大于0.1mol | |
| B. | 将足量甲加入到酚酞试液中,溶液先变红后褪色 | |
| C. | X与W构成的化合物、戊、己均为离子化合物 | |
| D. | W的简单离子半径大于Z的简单离子半径 |
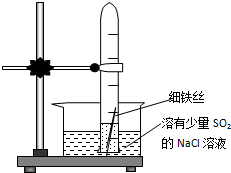 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿: 合成氨工业对工、农业生产和国防都有重要意义.
合成氨工业对工、农业生产和国防都有重要意义.