题目内容
19.下列物质中氧原子数目与17g H2O2中氧原子数一定相等的是( )| A. | 22.4L CO | B. | 4.4g CO2 | C. | 8 g SO3 | D. | 24.5g H2SO4 |
分析 根据n=$\frac{m}{M}$=$\frac{N}{{N}_{A}}$=$\frac{V}{{V}_{m}}$结合物质的构成计算,原子物质的量相同,则原子个数相同.
解答 解:n(H2O2)=$\frac{17g}{34g/mol}$=0.5mol,n(O)=2n(Na2O2)=1mol,原子物质的量相同,则原子个数相同,
A.气体存在的状态不一定为标准状况下,不能确定物质的量,故A错误;
B.n(CO2)=$\frac{4.4g}{44g/mol}$=0.1mol,n(O)=2n(CO2)=0.2mol,故B错误;
C.n(SO3)=$\frac{8g}{80g/mol}$=0.1mol,n(O)=3n(SO3)=0.3mol,故C错误;
D.n(H2SO4)=$\frac{24.5g}{98g/mol}$=0.25mol,n(O)=4n(H2SO4)=0.25mol×4=1mol,故D正确;
故选D.
点评 本题考查物质的量的计算,为高频考点,侧重于学生的分析能力和计算能力的考查,注意把握相关计算公式的运用以及物质的构成特点,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
9.铬铁矿的主要成分可表示为FeO•Cr2O3,还含有MgO、Al2O3、Fe2O3 等杂质,以下是以铬铁矿为原料制备重铬酸钾(K2Cr2O7)的流程图:

已知:①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是K2CrO7的溶解度比Na2Cr2O7小.
(3)操作Ⅲ有多步组成,获得K2Cr2O7晶体的操作依次是:加入KC1固体、蒸发浓缩、冷却结晶、过滤、洗涤、干燥.
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入足量CO2气体、…、灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26n}{17m}$×100%(用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定.若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O62-.

已知:①4FeO•Cr2O3+8Na2CO3+7O2═8Na2CrO4+2Fe2O3+8CO2↑;
②Na2CO3+Al2O3═2NaAlO2+CO2↑;
③Cr2O72-+H2O?2CrO42-+2H+
根据题意回答下列问题:
(1)操作I的名称是过滤.
(2)下表是相关物质的溶解度数据,操作Ⅲ发生反应的化学方程式是:Na2Cr2O7+2KCl═K2Cr2O7↓+2NaCl,该反应在溶液中能发生的理由是K2CrO7的溶解度比Na2Cr2O7小.
| 物质 | KCl | NaCl | K2Cr2O7 | Na2Cr2O7 | |
| 溶解度 (g/100g水) | 0℃ | 28 | 35.7 | 4.7 | 163 |
| 40℃ | 40.1 | 36.4 | 26.3 | 215 | |
| 80℃ | 51.3 | 38 | 73 | 376 | |
(4)副产品Y主要含氢氧化铝,还含少量镁、铁的难溶化合物及可溶性杂质,精确分析Y中氢氧化铝含量的方法是称取n g样品,加入过量NaOH溶液(填写试剂)、溶解、过滤、再通入足量CO2气体、…、灼烧、冷却、称量,得干燥固体m g.计算样品中氢氧化铝的质量分数为$\frac{26n}{17m}$×100%(用含m、n的代数式表示).
(5)称取重铬酸钾试样2.500g配成250mL溶液,取出25mL于碘量瓶中,加入10mL 2mol/L H2SO4和足量碘化钾,放于暗处5min.然后加入100mL水,加入3mL淀粉指示剂,用0.1000mol/LNa2S2O3标准溶液滴定.若实验中共用去Na2S2O3标准溶液47.40mL,则所得产品中重铬酸钾的纯度为92.9%.(保留3位有效数字)已知:①K2Cr2O7的摩尔质量为294g/mol
②Cr2O72-+6I-+14H+═2Cr3++3I2+7H2O;
I2+2S2O32-═2I-+S4O62-.
10.用中和滴定法测定某烧碱样品的纯度,若烧碱中含有不反应的杂质,试根据实验回答:
(1)将准确称好的5.0g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管处,还必须用到的玻璃仪器有250mL容量瓶.
(2)取待测液10.00mL,需用碱式滴定管(填仪器名称)量取,并置于锥形瓶中.
(3)向锥形瓶中滴加两滴指示剂,用0.200mol/L HCl溶液滴定烧碱溶液.不适宜选用的指示剂为(选序号填):①.
①石蕊溶液 ②酚酞溶液 ③甲基橙溶液
(4)滴定操作的要领是:左手握活塞,右手摇锥形瓶,眼睛要注视锥形瓶中溶液颜色的变化.
(5)根据下表实验数据,可计算出烧碱的纯度为80%.
(6)下列操作会使所测溶液的浓度数值偏高的是(填代号)AC.
A.酸式滴定管未用HCl溶液润洗就直接注入HCl溶液
B.锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C.装有HCl溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取HCl溶液体积时,开始仰视读数,滴定结束后俯视读数.
(1)将准确称好的5.0g烧碱样品配成250mL待测液,需要的主要仪器除量筒、烧杯、玻璃棒、胶头滴管处,还必须用到的玻璃仪器有250mL容量瓶.
(2)取待测液10.00mL,需用碱式滴定管(填仪器名称)量取,并置于锥形瓶中.
(3)向锥形瓶中滴加两滴指示剂,用0.200mol/L HCl溶液滴定烧碱溶液.不适宜选用的指示剂为(选序号填):①.
①石蕊溶液 ②酚酞溶液 ③甲基橙溶液
(4)滴定操作的要领是:左手握活塞,右手摇锥形瓶,眼睛要注视锥形瓶中溶液颜色的变化.
(5)根据下表实验数据,可计算出烧碱的纯度为80%.
| 滴定次数 | 待测液体积(mL) | HCl溶液体积(mL) | |
| 滴定前读数 | 滴定后读数 | ||
| 第一次 | 10.00 | 0.50 | 20.51 |
| 第二次 | 10.00 | 4.00 | 24.00 |
| 第三次 | 10.00 | 5.11 | 25.10 |
A.酸式滴定管未用HCl溶液润洗就直接注入HCl溶液
B.锥形瓶用蒸馏水洗净后没有干燥就注入NaOH待测液
C.装有HCl溶液的酸式滴定管在滴定前有气泡,滴定后气泡消失
D.读取HCl溶液体积时,开始仰视读数,滴定结束后俯视读数.
14.下列说法正确的是( )
| A. | BaO2(过氧化钡)固体中的阴离子和阳离子之比为2:1 | |
| B. | 在SiO2晶体中,1个Si原子和2个O原子形成2个共价键 | |
| C. | HCl的相对分子质量大于HF,所以HCl的沸点高于HF | |
| D. | 由ⅠA族和ⅥA族元素可形成原子个数比为1:1、电子总数为38的化合物 |
4.三峡工程是目前世界上最大的水利枢纽,它所提供的清洁、廉价、再生的水电,相当于每年燃烧5 000万吨原煤的火力发电厂产生的电能,因此三峡工程的建成和使用有助于控制( )
①氮氧化物的排放 ②酸雨的形成 ③臭氧层空洞扩大④温室效应 ⑤白色污染.
①氮氧化物的排放 ②酸雨的形成 ③臭氧层空洞扩大④温室效应 ⑤白色污染.
| A. | ①② | B. | ②④ | C. | ③④ | D. | ①②⑤ |
11.常温下,下列各组离子在指定溶液中一定能大量共存的是( )
| A. | 1.0 mol•L-1 KNO3溶液:H+、Fe2+、SCN-、SO42- | |
| B. | 水电离出的c(H+)=10-10 mol•L-1的溶液:K+、Ba2+、NO3-、Cl- | |
| C. | pH=0的溶液:Al3+、Ag(NH3)2+、Cl-、SO42- | |
| D. | c(ClO-)=1.0 mol•L-1的溶液:Na+、SO32-、S2-、SO42- |
8.下列有关氯气的说法正确的是( )
| A. | 氯气是黄绿色气体,有毒,有刺激性气味,氯水还可杀菌消毒 | |
| B. | 液氯就是氯气的水溶液,它能使干燥的有色布条褪色 | |
| C. | 红热的铁丝在Cl2中燃烧产生棕色的雾;H2在Cl2中燃烧火焰呈淡蓝色 | |
| D. | 氯水长时间放置会变质,是因为氯气几乎完全挥发,剩下的就是水. |
9.25℃,pH=2的 HC1溶液中,由水电离出的c(H+)是( )
| A. | 1×10-7 mol/L | B. | 1×10-12mol/L | C. | 1×10-2 mol/L | D. | 1×10-7 mol/L |
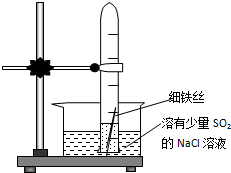 有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿:
有一研究性学习小组在探究有关钢铁的腐蚀情况,他们进行了如下实验:在一个水槽中盛装1000mL水,加入一定量的NaCl固体溶解后通入SO2气体至溶液pH值约为4左右,另取一支试管(带刻度,规格50mL),一条约5cm 的细铁丝,将铁丝放入试管中,加入约10mL前面配好的溶液,迅速用拇指扣住试管口倒扣于水槽中,用铁架台将试管固定,如图.过一会儿: