题目内容
14.已知反应4CO+2NO2?N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最慢的是( )| A. | v(CO)=1.5 mol•L-1•min-1 | B. | v(NO2)=0.7 mol•L-1•min-1 | ||
| C. | v(N2)=0.4 mol•L-1•min-1 | D. | v(CO2)=1.1 mol•L-1•min-1 |
分析 把不同物质的反应速率换算成同一物质的反应速率进行比较,而同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,据此分析解答.
解答 解:同一化学反应中,同一时间段内,各物质的反应速率之比等于其计量数之比,把不同物质的反应速率换算成同一物质的反应速率进行比较,数值越小的反应速率越慢,
A.v(CO)=1.5 mol•L-1•min-1;
B.v(CO)=2v(NO2)=1.4mol•L-1•min-1;
C.v(CO)=4v(N2)=1.6mol•L-1•min-1;
D.v(CO)=v(CO2)=1.1mol•L-1•min-1,
反应速率大小顺序是C>A>B>D,所以反应速率最慢的是D,故选D.
点评 本题考查化学反应速率大小比较,明确各物质反应速率与计量数的关系是解本题关键,也可以将反应速率与其计量数之比来比较反应速率大小,注意比较反应速率时单位要统一.

练习册系列答案
相关题目
15.下列物质中不属于电解质的是( )
| A. | KOH | B. | CuCl2 | C. | H2SO4 | D. | 蔗糖 |
5.铁盐是中学化学常见的盐.下面是以富含硫酸亚铁的工业废液为原料生产氧化铁和制备草酸亚铁晶体(FeC2O3•xH2O )的工艺流程图(部分操作和条件略).

请回答下列问题:
已知:①pH>4时,Fe2+易被氧气氧化;②NH4HCO3在热水中会分解;
③几种物质的溶解度(g/l00g H2O)如下
(1)流程图步骤Ⅰ中,在提纯时需要加足量的铁屑的原因是除去废液中的2Fe3+(或Fe+2Fe3+=3Fe2+).
(2)在生产氧化铁的步骤Ⅲ中,生成FeCO3的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(3)上述流程图制备草酸亚铁过程中,用稀硫酸调溶液pH至1〜2的目的是防止亚铁离子水解,防止亚铁离子氧化趁热过滤的原因是增大杂质的溶解度(防止低温时杂质析出),影响产品的纯度.
(4)己知煅烧FeCO3的化学方程式是4FeCO3+O2═2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO.则该产品中Fe2O3的质量是288.0kg.
(5)已知:某温度时,Ksp(FeC2O4)=1.0×10-6.Ksp(CaC2O4)=2.0×10-9,此温度下,FeC2O4若要在CaCl2溶液中开始转化为CaC2O4,则CaCl2的浓度必须不低于2.0×10-6mol•L-1.
(6)草酸(HzC2O4)是一种二元弱酸,广泛分布于动植物体中.已知0.1mol•L-1KHC2O4溶液呈酸性.下列说法正确的是ac(填字母序号)a、0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)═c(HC2O4-)+2c(C2O42-)+c(OH- )
b.0.1mol•L-1KHC2O4溶液中:c(K+)>c(HC2O4-)>c((H2C2O4)>c(C2O42-)
C.0.1mol/LKHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
d.浓度均为0.lmol•L-1KHC2O4和K2C2O4的混合溶液中:2c(K+)═c(HC2O4-)+c(C2O42-)

请回答下列问题:
已知:①pH>4时,Fe2+易被氧气氧化;②NH4HCO3在热水中会分解;
③几种物质的溶解度(g/l00g H2O)如下
| FeS04•7H2O | (NH4)2SO4 | FeSO4•(NH4)2SO4•6H2O | |
| 20℃ | 48 | 75 | 37 |
| 60℃ | 101 | 88 | 38 |
(2)在生产氧化铁的步骤Ⅲ中,生成FeCO3的离子方程式是Fe2++2HCO3-=FeCO3↓+CO2↑+H2O.
(3)上述流程图制备草酸亚铁过程中,用稀硫酸调溶液pH至1〜2的目的是防止亚铁离子水解,防止亚铁离子氧化趁热过滤的原因是增大杂质的溶解度(防止低温时杂质析出),影响产品的纯度.
(4)己知煅烧FeCO3的化学方程式是4FeCO3+O2═2Fe2O3+4CO2.现煅烧464.0kg的FeCO3,得到316.8kg产品.若产品中杂质只有FeO.则该产品中Fe2O3的质量是288.0kg.
(5)已知:某温度时,Ksp(FeC2O4)=1.0×10-6.Ksp(CaC2O4)=2.0×10-9,此温度下,FeC2O4若要在CaCl2溶液中开始转化为CaC2O4,则CaCl2的浓度必须不低于2.0×10-6mol•L-1.
(6)草酸(HzC2O4)是一种二元弱酸,广泛分布于动植物体中.已知0.1mol•L-1KHC2O4溶液呈酸性.下列说法正确的是ac(填字母序号)a、0.1mol•L-1KHC2O4溶液中:c(K+)+c(H+)═c(HC2O4-)+2c(C2O42-)+c(OH- )
b.0.1mol•L-1KHC2O4溶液中:c(K+)>c(HC2O4-)>c((H2C2O4)>c(C2O42-)
C.0.1mol/LKHC2O4溶液中滴加等浓度NaOH溶液至中性:c(K+)>c(Na+)
d.浓度均为0.lmol•L-1KHC2O4和K2C2O4的混合溶液中:2c(K+)═c(HC2O4-)+c(C2O42-)
9.下列说法正确的是( )
| A. | 电解MgCl2饱和溶液,可制得金属镁 | |
| B. | 采用牺牲阳极的阴极保护法:在海轮外壳连接锌块保护外壳 | |
| C. | 金属在潮湿空气中腐蚀的实质是:M+nH2O═M(OH)n+$\frac{n}{2}$ H2↑ | |
| D. | 地下钢管与外加直流电源的正极相连以保护它不受腐蚀 |
19.下列各表述与示意图一致的是( )
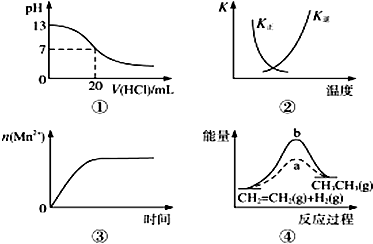

| A. | 图①表示25℃时,用0.1 mol•L-1盐酸滴定20 mL 0.1 mol•L-1 NaOH溶液,溶液的p随加入酸体积的变化 | |
| B. | 图②中曲线表示反应2SO2(g)+O2(g)?2SO3(g)△H<0正、逆反应的平衡常数K随温度的变化 | |
| C. | 图③表示10 mL 0.01 mol•L-1 KMnO4酸性溶液与过量的0.1 mol•L-1 H2C2O4溶液混合时,n(Mn2+)随时间的变化 | |
| D. | 图④中a、b曲线分别表示反应CH2═CH2(g)+H2(g)→CH3CH3(g)△H<0使用和未使用催化剂时,反应过程中的能量变化 |
6.磁流体是电子材料的新秀,它既具有固体的磁性,又具有液体的流动性,该流体在静态时无磁性吸引力,当外加磁场作用时,才表现出磁性,正因如此,它才在实际中有着广泛的应用,在理论上具有很高的学术价值.制备时将等物质的量FeSO4和Fe2(SO4)3溶液混合,滴入稍过量的氢氧化钠溶液,随后加入油酸钠溶液,即可生成黑色的分散质粒子直径在5.5-36nm的磁流体.下列说法中正确的是( )
| A. | 所得的分散系可用过滤的方法进行提纯 | |
| B. | 所得的分散系中分散质为Fe2O3 | |
| C. | 当一束强光通过该分散系时会出现光亮的通路 | |
| D. | 该分散系不稳定 |
3.下列物质的转化在给定条件下不能实现的是( )
| A. | Ca(ClO)2(aq)$\stackrel{CO_{2}}{→}$HClO(aq)$\stackrel{光照}{→}$HCl(aq) | |
| B. | H2SiO3$\stackrel{△}{→}$SiO2$\stackrel{HCl(aq)}{→}$SiCl4 | |
| C. | Al2O3 $→_{△}^{NaOH(ap)}$ NaAlO2(aq)$\stackrel{CO_{2}}{→}$Al(OH)3 | |
| D. | Fe2O3$\stackrel{H_{2}SO_{4}(aq)}{→}$Fe2(SO4)3(aq)$\stackrel{△}{→}$无水Fe2(SO4)3 |