题目内容
2.硫化钠是用于皮革鞣制的重要化学试剂,可用无水芒硝(Na2SO4)与炭粉在高温下反应而制得,有关反应原理如下:①Na2SO4+4C$\frac{\underline{\;高温\;}}{\;}$Na2S+4CO↑;
②Na2SO4+4CO$\frac{\underline{\;高温\;}}{\;}$Na2S+4CO2.
(1)现要制取Na2S 7.80g,若生产过程中无水芒硝(Na2SO4)的利用率为90%,则理论上需要无水芒硝(Na2SO4)15.78g(精确到0.01).
(2)若在反应中生成的Na2S物质的量为1mol,则消耗的碳单质的物质的量(n)的取值范围是2mol≤n≤4mol.
(3)若在上述反应中消耗的碳单质为1mol,生成Na2S的物质的量为y mol,而反应中生成的CO和CO2的物质的量之比为x,则y与x的关系式为:y=$\frac{2+x}{4+4x}$;
(4)Na2S放置在空气中,会缓慢氧化成Na2SO3及Na2SO4.现称取已经部分氧化的硫化钠样品39.20g溶于水中,加入足量盐酸,充分反应后,过滤得沉淀9.6g,放出H2S气体1.12L(标准状况).请计算得出在39.20g样品中各氧化产物的物质的量分别为:n(Na2SO3)=0.10mol、n(Na2SO4)=0.05mol.
分析 (1)该反应中遵循原子守恒,根据S原子守恒计算无水芒硝的质量;
(2)当完全生成CO时消耗的C物质的量最多,当完全生成二氧化碳时消耗C的物质的量最少,根据极限法分析解答;
(3)计算CO 和 CO2各自的物质的量,再根据电子转移守恒列等式,确定x 与 y的关系;
(4)Na2S与Na2SO3在酸性条件下发生反应:2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O,故9.6g为硫的质量,放出H2S气体2.24L,还发生反应H2SO4+Na2S=Na2SO4+H2S↑,根据n=$\frac{m}{M}$计算S的物质的量,进而计算生成S的反应中参加反应的Na2S、Na2SO3各自的物质的量,根据n=$\frac{V}{{V}_{m}}$计算H2S的物质的量,进而计算与硫酸反应生成H2S气体需要Na2SO3的物质的量,再根据m=nM计算样品中Na2S、Na2SO3各自的质量,继而计算Na2SO4的质量,根据n=$\frac{m}{M}$计算Na2SO4的物质的量.
解答 解:(1)7.80gNa2S的物质的量为 $\frac{7.8g}{78g/mol}$=0.1mol,根据硫元素守恒可知,需要无水芒硝的物质的量为$\frac{0.1mol}{90%}$=$\frac{1}{9}$mol,故需要芒硝的质量为$\frac{1}{9}$mol×142g/mol=15.78g,
故答案为:15.78;
(2)若生成的气体为CO,消耗的碳的物质的量最多,由Na2SO4+4C$\frac{\underline{\;高温\;}}{\;}$Na2S+4CO↑可知,生成1molNa2S需要碳的物质的量为mol×4=4mol,若生成的气体为CO2,消耗的碳的物质的量最少,根据电子转移守恒可知,生成1molNa2S需要碳的物质的量为 $\frac{1mol×[6-(-2)]}{4}$=2mol,故消耗的碳单质的物质的量 n的范围是2mol≤n≤4mol;
故答案为:2mol≤n≤4mol;
(3)消耗的碳单质为1mol,根据碳原子守恒,生成的 CO 和 CO2的总物质的量为1mol,生成的CO和CO2的物质的量之比为x,令CO2的物质的量为amol,则a+ax=1,故a=$\frac{1}{1+x}$,则CO的物质的量为$\frac{x}{1+x}$,反应生成 Na2S的物质的量为ymol,根据电子转移守恒有:y×[6-(-2)]=$\frac{1}{1+x}$×4+$\frac{x}{1+x}$×2,整理得y=$\frac{2+x}{4+4x}$,
故答案为:$\frac{2+x}{4+4x}$;
(4)9.6g为硫的物质的量为 $\frac{9.6g}{32g/mol}$=0.3mol,由方程式:2Na2S+Na2SO3+3H2SO4=3Na2SO4+3S↓+3H2O可知,参加该反应的Na2S为0.3mol×$\frac{2}{3}$=0.2mol,Na2SO3的物质的量为0.3mol×$\frac{1}{3}$=0.1mol,2.24LH2S气体的物质的量为 $\frac{11.2L}{22.4L/mol}$=0.05mol,根据反应H2SO4+Na2S=Na2SO4+H2S↑,可知,参加该反应的Na2S的物质的量为0.05mol,故样品中Na2SO4的质量为39.20g-0.1mol×126g/mol-(0.2mol+0.05mol)×78g/mol=7.1g,故Na2SO4的物质的量为 $\frac{7.1g}{142g/mol}$=0.05mol,
故78.40g样品中氧化产物:Na2SO3为0.2mol,Na2SO4为0.1mol,
故答案为:n(Na2SO3)=0.10 mol;n(Na2SO4)=0.05 mol.
点评 本题考查氧化还原反应有关计算,为高频考点,侧重考查学生分析计算能力,明确各个物理量之间的关系式是解本题关键,注意原子守恒的灵活运用,题目难度中等.

 第1卷单元月考期中期末系列答案
第1卷单元月考期中期末系列答案| A. | Mg2+、Al3+、Cl-、OH- | B. | Na+、Ba2+、OH-、SO42- | ||
| C. | K+、Na+、NO3-、HCO3- | D. | K+、NH4+、CO32-、OH- |
| A. | 0.087 | B. | 0.174 | C. | 0.06 | D. | 无法确定 |
| A. | 当一个可逆反应达到平衡状态时,这就是这个反应在该条件下所能达到的限度 | |
| B. | 可逆反应是指同一条件下,既能向正反应方向进行,又能向逆反应方向同时进行的反应 | |
| C. | 平衡状态的本质是各反应物、生成物的分子个数不再随时间改变而改变 | |
| D. | 金属钠在氧气中燃烧瞬间达到平衡状态 |
| A. | 2mol | B. | 4mol | C. | 5mol | D. | 6mol |
| A. | v(CO)=1.5 mol•L-1•min-1 | B. | v(NO2)=0.7 mol•L-1•min-1 | ||
| C. | v(N2)=0.4 mol•L-1•min-1 | D. | v(CO2)=1.1 mol•L-1•min-1 |
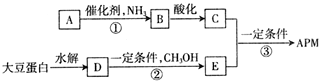
 .C中所含官能团的名称为羧基、氨基.
.C中所含官能团的名称为羧基、氨基. .
.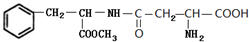 和
和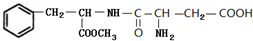 .
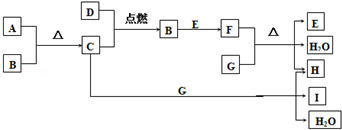
.
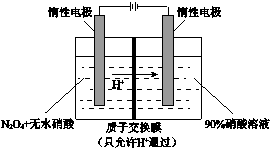 氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.