题目内容
4.0.3mol某金属单质与足量的稀硫酸充分作用后,在标准状况下生成10.08L H2和51.30g该金属的硫酸盐,若该金属原子核内的质子数比中子数少一个,试通过计算推导该金属在周期表中的位置.分析 n(H2)=$\frac{10.08L}{22.4L/mol}$=0.45mol,根据电子转移守恒可知金属的化合价为$\frac{0.45mol×2}{0.3mol}$=+3,硫酸盐可表示为A2(SO4)3,根据A原子守恒计算 A2(SO4)3的物质的量,结合硫酸盐的质量可知Mr[A2(SO4)3],进而计算A的相对原子质量确定元素.
解答 解:n(H2)=$\frac{10.08L}{22.4L/mol}$=0.45mol,
根据电子转移守恒可知金属的化合价为$\frac{0.45mol×2}{0.3mol}$=+3,
所以该金属的硫酸盐的化学式为A2(SO4)3,
n[A2(SO4)3]=$\frac{1}{2}$×n(A)=0.15mol,
故Mr[A2(SO4)3]=2Mr(A)+3×96=$\frac{51.3}{0.15}$=342,
可知Mr(A)=27,
该金属原子核内的质子数比中子数少一个,则质子数为13,则该金属为Al,位于周期表第三周期ⅢA族,
答:该元素处于第三周期第ⅢA族.
点评 本题考查原子结构与元素的性质,侧重于学生的分析能力和计算能力的考查,注意从电子转移的角度判断金属的化合价.

练习册系列答案
 名师点睛字词句段篇系列答案
名师点睛字词句段篇系列答案
相关题目
14.已知反应4CO+2NO2?N2+4CO2在不同条件下的化学反应速率如下,其中表示反应速率最慢的是( )
| A. | v(CO)=1.5 mol•L-1•min-1 | B. | v(NO2)=0.7 mol•L-1•min-1 | ||
| C. | v(N2)=0.4 mol•L-1•min-1 | D. | v(CO2)=1.1 mol•L-1•min-1 |
15.以下是一些原子的2p能级和3d能级中电子排布的情况.其中违反了洪特规则的是( )
①
②
③
④
⑤
⑥
①

②

③

④

⑤

⑥

| A. | ④⑥ | B. | ②③ | C. | ②④⑤ | D. | ②③④⑥ |
19.X元素的化合价为+m价,Y元素的化合价为-n价,那么X和Y组成的化合物的一个分子中,原子个数( )
| A. | 一定是m个 | B. | 一定是n个 | C. | 一定是(m+n)个 | D. | 可能是(m+n)个 |
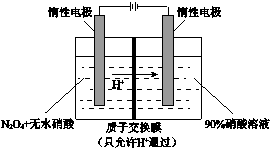 氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义.
氮氧化物(NOx)种类很多,造成大气污染的主要是NO和NO2,研究它们的综合利用有重要意义. 某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题:
某烃A是有机化学工业的基本原料,其产量可以用来衡量一个国家的石油化工发展水平,A还是一种植物生长调节剂,A可发生如图所示的一系列化学反应,其中①②③属于同种反应类型.根据如图回答下列问题: (填电子式),B
(填电子式),B (填结构式),E
(填结构式),E (填结构简式).
(填结构简式).