题目内容
C、N、Cl是非常重要的非金属元素
(1)写出常温下Cl2和强碱溶液反应的离子方程式 .
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4气态分子.N4分子结构与白磷分子结构相似 ,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是: .
,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是: .
(3)由N、Cl两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是 .
(4)C、N两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,C、N原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为 ,其熔沸点比金刚石 (填“高”、“低”或“无法比较”).
(1)写出常温下Cl2和强碱溶液反应的离子方程式
(2)意大利罗马大学的FuNvio Cacace等人获得了极具理论研究意义的N4气态分子.N4分子结构与白磷分子结构相似
 ,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:
,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:(3)由N、Cl两种元素组成的化合物X,常温下为易挥发的淡黄色液体,X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构.X遇水蒸气可形成一种常见的漂白性物质.则X与水反应的化学方程式是
(4)C、N两种元素可形成一种硬度比金刚石还大的化合物Y.在化合物Y中,C、N原子间以单键相结合,且每个原子的最外层均达到8个电子的稳定结构.则Y的化学式为
考点:离子方程式的书写,晶体熔沸点的比较,反应热和焓变,氯、溴、碘及其化合物的综合应用
专题:基本概念与基本理论
分析:(1)常温下Cl2和强碱溶液反应生成氯化钠和次氯酸钠、水;
(2)根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较,物质具有的能量越低越稳定;
(3)依据X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构,推出x为NCl3,遇水蒸气可形成一种常见的漂白性物质,推出生成物一种为HClO,依据氧化还原反应规律写出化学方程式;
(4)依据C、N两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构,推断Y的化学式,依据原子晶体共价键键长越断,共价键越稳定,熔沸点越高判断二者沸点高低.
(2)根据化学键断裂要吸收热量,形成化学键要放出热量,分别计算后进行比较,物质具有的能量越低越稳定;
(3)依据X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构,推出x为NCl3,遇水蒸气可形成一种常见的漂白性物质,推出生成物一种为HClO,依据氧化还原反应规律写出化学方程式;
(4)依据C、N两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构,推断Y的化学式,依据原子晶体共价键键长越断,共价键越稳定,熔沸点越高判断二者沸点高低.
解答:
解:(1)常温下Cl2和强碱溶液反应的离子方程式为:Cl2+2OH-=Cl-+ClO-+H2O,
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以1mo1N4气体转变为N2将放热,氮气的能量更低,更加稳定,
故答案为:N4<N2;
(3)X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构,则X的分子式为NCl3,遇水蒸气可形成一种常见的漂白性物质,该物质为HClO,与水反应的化学方程式为:NCl3+3H2O=NH3+3HClO,
故答案为:NCl3+3H2O=NH3+3HClO;
(4)C、N两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构,形成一种硬度比金刚石还大的化合物Y,则Y的化学式为C3N4,由于N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的沸点比金刚石沸点高,
故答案为:C3N4;高.
故答案为:Cl2+2OH-=Cl-+ClO-+H2O;
(2)1molN4气体中含有6molN-N键,可生成2molN2,形成2molN≡N键,则1molN4气体转变为N2化学键断裂断裂吸收的热量为6×167KJ=1002KJ,形成化学键放出的热量为1884KJ,所以1mo1N4气体转变为N2将放热,氮气的能量更低,更加稳定,
故答案为:N4<N2;
(3)X分子为三角锥形分子,且分子里B、C两种原子最外层均达到8个电子的稳定结构,则X的分子式为NCl3,遇水蒸气可形成一种常见的漂白性物质,该物质为HClO,与水反应的化学方程式为:NCl3+3H2O=NH3+3HClO,
故答案为:NCl3+3H2O=NH3+3HClO;
(4)C、N两原子以单键相结合,且每个原子的最外层均达到8个电子的稳定结构,形成一种硬度比金刚石还大的化合物Y,则Y的化学式为C3N4,由于N的原子半径比C的原子半径小,C-N键长比C-C键长短,C-N键能比C-C键能大,所以C3N4的沸点比金刚石沸点高,
故答案为:C3N4;高.
点评:本题考查了离子方程式的书写,反应热的求算,晶体沸点规律,题目综合性强,难度中等,注意:1.N4分子结构中共价键的个数;2.原子晶体沸点规律.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
下列叙述不正确的是( )
| A、常温下,SO2、NO2、Cl2均为有刺激性气味、有毒的气体 |
| B、Na2CO3粉末遇水生成含有结晶水的碳酸钠晶体,该晶体一定是Na2CO3?10H2O |
| C、人工合成的硅橡胶是目前最好的、既耐高温又耐低温的橡胶 |
| D、合金的硬度可以大于它的纯金属成分,合金的熔点也可以低于它的成分金属 |
在生活、生产中为增大反应速率而采取的措施合理的是( )
| A、食物放在冰箱中 |
| B、塑料制品中添加抑制剂 |
| C、在糕点包装内放置小包除氧剂 |
| D、燃煤发电时用煤粉代替煤块 |
炼钢时常用的氧化剂是空气(或纯氧).炼钢过程中既被氧化又被还原的元素是( )
| A、铁 | B、硫 | C、氧 | D、碳 |
以下关于原子的未成对电子数的叙述正确的是( )
①钠、铝、氯:1个;②硅、硫:2个;③磷:3个;④铁:4个.
①钠、铝、氯:1个;②硅、硫:2个;③磷:3个;④铁:4个.
| A、只有①③ | B、只有①②③ |
| C、只有②③④ | D、有①②③④ |
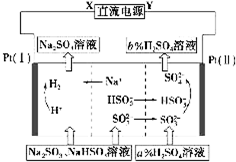 用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )
用Na2SO3溶液吸收硫酸工业尾气中的二氧化硫,将所得的混合液进行电解循环再生,这种新工艺叫再生循环脱硫法.其中阴、阳离子交换膜组合循环再生机理如图所示,则下列有关说法中正确的是( )| A、X为直流电源的正极,Y为直流电源的负极 |
| B、阳极区pH减小 |
| C、图中的b<a |
| D、阴极的电极反应为HSO3--2e-+H2O═SO42-+3H+和SO32--2e-+2H2O═SO42-+4H+ |

 焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验:
焦亚硫酸钠(Na2S2O5)是常用的食品抗氧化剂之一.某研究小组进行如下实验: