题目内容
(1)已知:2NO2(g)?N2O4(g);△H<0.在恒温恒容条件下,将一定量NO2和N2O4的混合气体通入容积为2L的密闭容器中,反应过程中各物质的物质的量浓度c随时间t的变化关系如图所示.

①a、b、c、d四个点中,表示化学反应处于平衡状态的点是 .
②前10min内用NO2表示的化学反应速率v(NO2)= mol?L-1?min-1.反应在第一个平衡点的平衡常数K(1)= (可用分数表示).反应在第二个平衡点的平衡常数K(2)与第一个平衡点的平衡常数K(1)的关系:K(2) K(1)(填“>”、“=”或“<”).
③请在如图坐标中画出1mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(2)图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图.试回答下列问题:
①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系 .
②写出硒化氢发生分解反应的热化学反应方程式: .

①a、b、c、d四个点中,表示化学反应处于平衡状态的点是
②前10min内用NO2表示的化学反应速率v(NO2)=
③请在如图坐标中画出1mol N2O4通入2L的密闭容器中反应发生过程中的能量变化示意图,并在虚线上分别标出反应物和生成物的化学式.
(2)图中a、b、c、d分别代表氧族元素(ⅥA族):Te(碲)、Se(硒)、S、O氢化物的反应热的数据示意图.试回答下列问题:
①请你归纳:非金属元素氢化物的稳定性与形成氢化物的反应热△H的关系
②写出硒化氢发生分解反应的热化学反应方程式:
考点:物质的量或浓度随时间的变化曲线,热化学方程式,反应速率的定量表示方法,化学平衡常数的含义
专题:化学反应中的能量变化,化学平衡专题
分析:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线,
①根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
②根据v=
求得速率,根据平衡常数的定义和图中的平衡浓度可求得平衡常数,根据影响平衡常数的因素可比较出K(2)、K(1)的大小;
③根据反应中的能量变化可以画出相关的图;
(2)①根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
(3)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
①根据图象及物质的浓度不发生变化时表示化学反应处于平衡状态;
②根据v=
| △c |
| △t |
③根据反应中的能量变化可以画出相关的图;
(2)①根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定,以此进行判断;
(3)根据图象判断出abcd对应的各氢化物,根据焓变的大小书写热化学方程式.
解答:
解:(1)由图可知10-25min平衡状态时,X表示的生成物的浓度变化量为(0.6-0.2)mol/L=0.4mol/L,Y表示的反应物的浓度变化量为(0.6-0.4)mol/L=0.2mol/L,X表示的生成物的浓度变化量是Y表示的反应物的浓度变化量的2倍,所以X表示NO2浓度随时间的变化曲线,Y表示N2O4浓度随时间的变化曲线;
①由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d;
②由图可知,前10min内用NO2的物质的量浓度变化了0.4mol/L,故化学反应速率v(NO2)=
=0.04mol?L-1?min-1,
由图可知,在第一个平衡点c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,故平衡常数K=
=
=
,
由于平衡常数只与温度有关,所以当温度不变时,平衡常数不变,故答案为:0.04;
;=;
③根据反应2NO2(g) N2O4(g);△H<0可知,反应物NO2(g)中的能量比生成物N2O4(g)中的高,故可以画出图为:
N2O4(g);△H<0可知,反应物NO2(g)中的能量比生成物N2O4(g)中的高,故可以画出图为: ,故答案为
,故答案为
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O.
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
(3)由(2)可知,b为硒化氢的生成热数据,则硒化氢分解吸热,且△H=-81kJ/mol,
所以H2Se发生分解反应的热化学反应方程式为H2Se(g)=Se(s)+H2(g),△H=-81kJ/mol
故答案为:H2Se(g)=Se(s)+H2(g),△H=-81kJ/mol.
①由图可知,10-25min及35min之后X、Y的物质的量不发生变化,则相应时间段内的点处于化学平衡状态,即b、d处于化学平衡状态,故答案为:b、d;
②由图可知,前10min内用NO2的物质的量浓度变化了0.4mol/L,故化学反应速率v(NO2)=
| 0.4mol/L |
| 10min |
由图可知,在第一个平衡点c(NO2)=0.6mol/L,c(N2O4)=0.4mol/L,故平衡常数K=
| c(N 2O4) |
| c2(NO2) |
| 0.4mol/L |
| (0.6mol/L)2 |
| 10 |
| 9 |
由于平衡常数只与温度有关,所以当温度不变时,平衡常数不变,故答案为:0.04;
| 10 |
| 9 |
③根据反应2NO2(g)
 N2O4(g);△H<0可知,反应物NO2(g)中的能量比生成物N2O4(g)中的高,故可以画出图为:
N2O4(g);△H<0可知,反应物NO2(g)中的能量比生成物N2O4(g)中的高,故可以画出图为: ,故答案为
,故答案为
(2)非金属元素氢化物的稳定性与生成1mol氢化物时的△H的关系为:根据元素周期律,同一主族元素非金属性越强,生成气态氢化物越容易,气态氢化物越稳定;而根据热力学,能量越低越稳定.a、b、c、d依次为H2Te、H2Se、H2S、H2O.
故答案为:非金属元素氢化物越稳定,△H越小,反之亦然;
(3)由(2)可知,b为硒化氢的生成热数据,则硒化氢分解吸热,且△H=-81kJ/mol,
所以H2Se发生分解反应的热化学反应方程式为H2Se(g)=Se(s)+H2(g),△H=-81kJ/mol
故答案为:H2Se(g)=Se(s)+H2(g),△H=-81kJ/mol.
点评:本题考查了平衡状态的判断、反应速率的计算、影响平衡常数的因素、化学反应与能量变化等知识,题目难度不大,本题注意从图象判断各种氢化物的种类为解答该题的关键.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
下列离子方程式书写不正确的是( )
| A、NaOH溶液与SO2反应,当n(NaOH):n(SO2)=4:3时,4OH-+3SO2═SO32-+2HSO3-+H2O |
| B、CuCl2溶液与Na2S溶液2:1反应:Cu2++S2-═CuS↓ |
| C、1mol?L-1的NaAlO2溶液和2.5mol?L-1的盐酸等体积互相均匀混合:2AlO2-+5H+═Al(OH)3↓+Al3++H2O |
| D、Cl2与FeBr2溶液反应,当n(Cl2):n(FeBr2)=1:1时:2Fe2++4Br-+3Cl2═2Fe3++2Br2+6Cl- |
下列说法正确的是( )
| A、常温常压下,16g O3含有NA个O3 |
| B、1mol?L-1的Ca(ClO)2溶液中含ClO-数目为2NA |
| C、标准状况下,22.4L HCl溶于1L水中所得的盐酸含有NA个HCl分子 |
| D、1mol Mg在空气中完全燃烧生成MgO和Mg3N2,失去2NA个电子 |
设NA为阿伏加德罗常数的值.下列说法正确的是( )
| A、0.1mol N2与足量的H2反应,转移的电子数是0.6NA |
| B、常温下,0.1mol?L-1 NH4NO3溶液中含有的氮原子数是0.2NA |
| C、常温常压下,3.2g O2和3.2g O3所含氧原子数都是0.2NA |
| D、2.24L CO和CO2的混合气体中所含的碳原子数为0.1N A |
能正确表示下列反应的离子方程式的是( )
A、用铜作电极电解CuSO4溶液:2Cu2++2H2O
| ||||
| B、0.01mol/L NH4Al(SO4)2溶液与0.02 mol/L Ba(OH)2溶液等体积混合:A13++2SO42-+2Ba2++4OH-═2BaSO4↓+AlO2-+2H2O | ||||
| C、少量二氧化硫通入次氯酸钠碱性溶液中:SO2+ClO-+2OH-═SO42-+Cl-+H2O | ||||
| D、Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-═CaCO3↓+H2O |
等质量的铁屑和锌粒与足量的同浓度的稀硫酸反应,下列图象可能正确的是( )
A、 |
B、 |
C、 |
D、 |
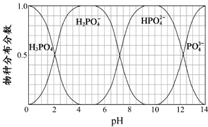 磷和砷是同主族的非金属元素.
磷和砷是同主族的非金属元素.
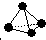 ,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是:
,已知断裂1mol N-N键吸收167kJ的热量,生成1mol N≡N键放出942kJ热量.试判断相同条件下N4与N2的稳定性顺序是: