题目内容
4.pC类似pH,是指溶液中溶质物质的量浓度的常用对数的负值,如某溶液的浓度为1×10-2mol/L,则溶液中该溶质的pC=-lg1×10-2=2.已知H2RO3溶液中存在的化学平衡为:RO2(g)+H2O?H2RO3?H++HRO3-,HRO3-?H++RO32-.图1为H2RO3饱和溶液的pC-pH图.请回答下列问题: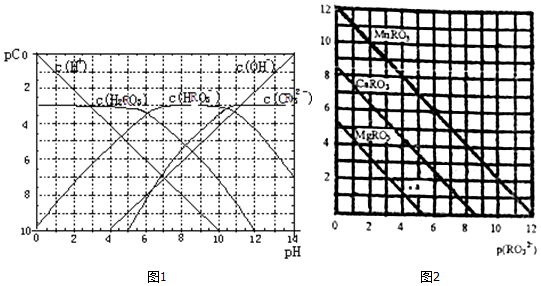
(1)在pH=2~4时,H2RO3溶液中主要存在的离子为:H+、HRO3-;
(2)H2RO3一级电离平衡常数的数值Ka1≈1×10-6;
(3)已知:298K时,H2RO3的电离常数Ka2=5.6×10-11.观察图1判断NaHRO3溶液呈碱性;再通过计算,利用电离、水解平衡常数说明理由Kh=$\frac{c({H}_{2}R{O}_{3})c(O{H}^{-})}{c(HR{{O}_{3}}^{-})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8>Ka2,HRO3-水解程度大于电离程度,故溶液呈碱性.
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是在该溶液中加入少量的酸,使平衡:HRO3-?H++RO32-向左移动,结果溶液中H+浓度增加很少;若在溶液中加入少量的碱,使平衡HRO3-?H++RO32-向右移动,结果溶液中OH-浓度也增加不大.
(5)一定温度下,三种盐MRO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解曲线如图2所示.已知:p(M2+)=-lg c(M2+),p(RO32-)=-lgc(RO32-)
①MgRO3、CaRO3、MnRO3的Ksp由大到小的顺序为Ksp(MgRO3)>Ksp(CaRO3)>Ksp(MnRO3).
②a 点时c(Mg2+)>c(RO32-) (填“>”或“<”或“=”),此时MgRO3溶液未达饱和(填“己达饱和”或“未达饱和”)
③现欲将某溶液中的Mn2+以MnRO3盐的形式沉淀完全(溶液中Mn2+离子的浓度小于l×10-5mol/L),则最后溶液中的p(RO32-)的范围是<7.
分析 (1)在pH=2~4时从图形分析判断,主要存在微粒为H+、HRO3-、H2RO3;
(2)H2RO3一级电离平衡常数Ka1=$\frac{c({H}^{+})c(HR{{O}_{3}}^{-})}{c({H}_{2}R{O}_{3})}$,结合图象数据计算;
(3)观察图1判断NaHRO3溶液PH大于7溶液显碱性;利用电离、水解平衡常数计算分析判断;
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,溶液中存在电离平衡和水解平衡,相互抑制,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大;
(5)①溶度积常数=c(M2+)c(RO32-),图象分析可知大小;
②a点可表示MgRO3的不饱和溶液,p(M2+)<p(RO32-),pM数值越小,实际浓度越大;
③图象计算溶度积常数Ksp=c(Mn2+)c(RO32-)=10-12,将某溶液中的Mn2+以MnRO3盐的形式沉淀完全,溶液中Mn2+离子的浓度小于l×10-5mol/L,计算得到RO32-浓度,得到p(RO32-)的范围;
解答 解:(1)在pH=2~4时,H2RO3溶液中主要存在的离子为H+、HRO3-,
故答案为:H+、HRO3-;
(2)H2RO3一级电离平衡常数随温度变化,不随浓度变化,图象中分析可知Ka1=$\frac{c({H}^{+})c(HR{{O}_{3}}^{-})}{c({H}_{2}R{O}_{3})}$=c(H+)=1×10-6,
故答案为:1×10-6;
(3)已知:298K时,H2RO3的电离常数Ka2=5.6×10-11.观察图1判断NaHRO3溶液呈碱性,水解为:HRO3-+H2O?H2RO3+OH-,Kh=$\frac{c({H}_{2}R{O}_{3})c(O{H}^{-})}{c(HR{{O}_{3}}^{-})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8>Ka2,HRO3-水解程度大于电离程度,故溶液呈碱性,
故答案为:碱性;Kh=$\frac{c({H}_{2}R{O}_{3})c(O{H}^{-})}{c(HR{{O}_{3}}^{-})}$=$\frac{Kw}{K{a}_{1}}$=$\frac{1{0}^{-14}}{1{0}^{-6}}$=10-8>Ka2,HRO3-水解程度大于电离程度,故溶液呈碱性;
(4)一定浓度的NaHRO3和Na2RO3混合溶液是一种“缓冲溶液”,在这种溶液中加入少量的强酸或强碱,溶液的pH变化不大,其原因是:在该溶液中加入少量的酸,使平衡:HRO3-?H++RO32-向左移动,结果溶液中H+浓度增加很少;若在溶液中加入少量的碱,使平衡HRO3-?H++RO32-向右移动,结果溶液中OH-浓度也增加不大,
故答案为:在该溶液中加入少量的酸,使平衡:HRO3-?H++RO32-向左移动,结果溶液中H+浓度增加很少;若在溶液中加入少量的碱,使平衡HRO3-?H++RO32-向右移动,结果溶液中OH-浓度也增加不大;
(5)①溶度积常数=c(M2+)c(RO32-),MgRO3、CaRO3、MnRO3的Ksp由大到小的顺序为Ksp(MgRO3)>Ksp(Ca RO3)>Ksp(Mn RO3),
故答案为:Ksp(MgRO3)>Ksp(Ca RO3)>Ksp(Mn RO3);
②a点可表示MgRO3的不饱和溶液,p(M2+)<p(RO32-),pM数值越小,实际浓度越大;图象可知c(Mg2+)>c(RO32-),此时MgRO3溶液未达到饱和溶液,
故答案为:>,未达饱和;
③图象计算溶度积常数Ksp=c(Mn2+)c(RO32-)=10-12,将某溶液中的Mn2+以MnRO3盐的形式沉淀完全,溶液中Mn2+离子的浓度小于l×10-5mol/L,计算得到RO32-浓度c(RO32-)=10-7mol/L,得到p(RO32-)的范围<7,
故答案为:<7;
点评 本题考查了弱电解质电离平衡、盐类水解、电离平衡常数计算和溶度积常数计算,主要是图象的分析应用,掌握基础是解题关键,题目难度中等.

 名校课堂系列答案
名校课堂系列答案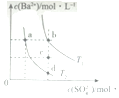
| A. | T1时,c点有沉淀生成 | |
| B. | T2时,蒸发溶剂可能由d点变到b点 | |
| C. | T2时,由a点开始加入BaCl2固体,Ksp增大 | |
| D. | BaSO4的溶解度随温度升高而增大 |
①主反应;CH4(g)+$\frac{1}{2}$O2(g)═CO(g)+2H2(g)△H1
②副反应:CH4(g)+2O2(g)═CO2(g)+2H2O(g)△H2
③主反应:CH4(g)+H2O(g)═CO+3H2(g)△H3=206.1KJ•mol-1
④主反应:CO(g)+2H2(g)═CH3OH(g)△H4=90.0KJ•mol-1
⑤副反应:CO2(g)+3H2(g)═CH3OH(g)+H2O(g)△H5=49.0KJ•mol-1
下列说法正确的是( )
| A. | △H1>△H2 | |
| B. | 设计反应①的主要目的是增大n(CO)/n(H2)的比值 | |
| C. | CO(g)+H2O(g)?CO2(g)+H2(g)的正反应为吸热反应 | |
| D. | △H2=4△H1=659.3 KJ•mol-1 |
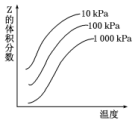 如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )
如图是温度和压强对反应X+Y?2Z影响的示意图.图中纵坐标表示平衡混合气体中Z的体积分数.下列叙述正确的是( )| A. | 恒容时,混合气体的密度可作为此反应是否达到化学平衡状态的判断依据 | |
| B. | X、Y、Z均为气态 | |
| C. | 上述反应的逆反应的△H>0 | |
| D. | 使用催化剂Z的产率提高 |
①1s22s22p63s23p4;②1s22s22p63s23p3;③1s22s22p5.则下列有关比较中正确的是( )
| A. | 第一电离能:③>②>① | B. | 原子半径:③>②>① | ||
| C. | 电负性:③>①>② | D. | 最高化合价:②>①>③ |
| A. | 常温常压下,氯气的摩尔质量等于71g | |
| B. | 1molH2SO4中含有2mol氢元素 | |
| C. | 某物质的摩尔质量就是该物质的相对分子质量或相对原子质量 | |
| D. | 2g氦气所含的原子数目约为0.5×6.02×1023 |
| 实验 序号 | 反应温 度/℃ | Na2S2O3溶液 | 稀硫酸 | H2O | ||
| V/mL | c/mol•L-1 | V/mL | c/mol•L-1 | V/mL | ||
| ① | 20 | 10.0 | 0.10 | 10.0 | 0.50 | 0 |
| ② | 40 | V1 | 0.10 | V2 | 0.50 | V3 |
| ③ | 20 | V4 | 0.10 | 4.0 | 0.50 | V5 |
(2)下列有关该实验的叙述正确的是A(填字母).
A.实验前,应先用黑墨水笔在白纸上画粗浅一致的“+”字,衬在锥形瓶底部,实验中记录反应开始到产生的浑浊将锥形瓶底部的“+”字刚好完全遮盖所需的时间
B.该实验所需的计量仪器有量筒、温度计
C.实验时,应先将量取的Na2S2O3和H2SO4溶液混合,然后置于相应温度的热水浴中反应,记录每组反应所需时间
(3)实验过程中为什么不用测量一定时间内放出SO2气体的量来表示该反应的化学反应速率的大小?SO2易溶于水,无法准确测量其体积.
Ⅱ.已知:NH2COONH4+2H2O?NH4HCO3+NH3•H2O,该研究小组分别用三份不同初始浓度的氨基甲酸铵溶液测定水解反应速率,得到c(NH2COO-)随时间的变化趋势如图2所示.
(4)25.0℃时,0~6min氨基甲酸铵水解反应的平均速率为0.05mol/(L•min).
(5)根据图中信息,如何说明该水解反应的速率随温度升高而增大:25℃反应物起始浓度较小,但0~6min的平均反应速率(曲线的斜率)仍比15℃大.
| A. | 即将发射的嫦娥五号卫星使用的碳纤维是一种新型无机非金属材料 | |
| B. | 我国古代闻名于世界的化学工艺有烧陶瓷、造纸、冶金、制火药等 | |
| C. | 夏天雷雨过后感觉到空气清新是因为空气中产生了少量的氮氧化物 | |
| D. | 绿色化学的核心是利用化学原理从源头上减少和消除工业生产对环境的污染 |