题目内容
7.化学与生活、社会发展息息相关.下列说怯不正确的是( )| A. | 黑火药由硝石、硫磺、木炭按一定比例混合制成,其中“硝石”指的是硝酸钾 | |
| B. | “青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程属于化学变化 | |
| C. | “丹砂(HgS)烧之成水银,积变又还成了丹砂”,该过程发生了分解、化合反应 | |
| D. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 |
分析 A.依据黑火药成分解答;
B.有新物质生成的变化是化学变化;
C.丹砂即硫化汞,加热即分解而得到汞.汞与硫磺化合又生成黑色的硫化汞;
D.侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,由于NaHCO3溶解度小于Na2CO3,故NaHCO3在溶液中析出;
解答 解:A.制备黑火药的原料为S、KNO3、C,三者比例为1:2:3,故A正确;
B.青篙一握,以水二升渍,绞取汁”,该挺取青蒿素的过程为萃取过程,没有新物质生成,属于物理变化,故B错误;
C.丹砂即硫化汞,加热即分解而得到汞.汞与硫磺化合又生成黑色的硫化汞,故C正确;
D.侯氏制碱法是将CO2、NH3通入饱和NaCl溶液中,发生以下反应:NH3+CO2+H2O=NH4HCO3;NH4HCO3+NaCl=NH4Cl+NaHCO3↓,其中NaHCO3溶解度最小,故有NaHCO3的晶体析出,故D正确;
故选:B.
点评 本题为综合题,考查物理变化与化学变化的判断、侯氏制碱法原理、黑火药成分等知识,与人们日常生活紧密结合,均为最基本化学常识,选项B为易错点,关键在于判断变化过程中是否有新物质生成.

练习册系列答案
相关题目
17.在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量QkJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
18.有关苯酚的下列叙述中,错误的是( )
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
15.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
2.NA为阿伏加德罗常数的值,下列叙述正确的是( )
| A. | 16g O2和O3的混合气体中含有的分子数为0.5NA | |
| B. | 25℃时,KSP(BaSO4)=1×10-10,则BaSO4饱和溶液中Ba2+数目为1×10-5NA | |
| C. | 标准状况下,2.24L Cl2通入足量H2O或NaOH溶液中转移的电子数均为0.1NA | |
| D. | 常温下,1mol的NaHCO3固体中含HCO3-的数目为NA |
5.一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
| A. | 过量的氢气与氧气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
6.用沉淀法测定 KHCO3和 Na2CO3 固体混合物的组成,每次称取一定质量的样品溶于水制成溶液,向其中滴加相同浓度的 Ba(OH)2 溶液,每次实验均充分反应,反应前后溶液体积变化忽略不计,实验记录见表:
回答下列问题:
(1)样品中KHCO3和Na2CO3 的物质的量之比2:1.
(2)室温下第III组实验所得溶液中的 OH-物质的量浓度为0.6mol/L.
| 实验序号 | I | II | III | IV | Ⅴ |
| 样品质量(g) | 3.06 | 6.12 | 9.18 | 12.24 | 15.30 |
| Ba(OH)2溶液体积(mL) | 300 | 300 | 300 | 300 | 300 |
| 生成沉淀的质量(g) | 5.91 | 11.82 | 17.73 | 23.64 | 23.64 |
(1)样品中KHCO3和Na2CO3 的物质的量之比2:1.
(2)室温下第III组实验所得溶液中的 OH-物质的量浓度为0.6mol/L.
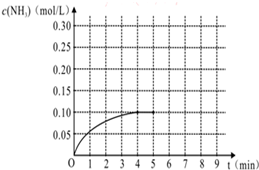 在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图:
在一容积为4L的密闭容器中,加入0.4mol的N2和1.2mol的H2,在一定条件下发生如下反应:N2(g)+3H2(g)?2NH3(g )△H<0,反应中NH3的物质的量浓度变化情况如图: