题目内容
5.下列表述错误的是( )| A. | 中子数为20的氯原子:${\;}_{17}^{37}$Cl | |
| B. | 碳酸钠水解的离子方程式:CO32-+2H2O?OH-+H2CO3 | |
| C. | CH3COOH的电离方程式为:CH3COOH+H2O?CH3COO-+H3O+ | |
| D. | 次氯酸的结构式:H-O-Cl |
分析 A.元素符号的左上角标质量数,质量数=质子数+中子数;
B.碳酸钠为盐,完全电离,碳酸根离子水解分步进行,以第一步为主,不能一步完成;
C.CH3COOH是弱酸部分电离,H3O+为水合氢离子;
D.HClO中Cl原子只形成1个共价键.
解答 解:A.氯元素的质子数为17,中子数为20的氯原子的质量数=17+20=37,该原子正确的表示方法为:1737Cl,故A正确;
B.碳酸钠为盐,完全电离,碳酸根离子水解分步进行,以第一步为主:CO32-+H2O?HCO3-+OH-,第二步水解为:HCO3-+H2O?H2CO3+OH-,故B错误;
C.CH3COOH是弱酸在溶液中部分电离,其电离方程式为:CH3COOH?CH3COO-+H+,H3O+为水合氢离子,或写成CH3COOH+H2O?CH3COO-+H3O+,故C正确;
D.次氯酸分子中存在1个氢氧键和1个氧氯键,其结构式为:H-O-Cl,故D正确;
故选B.
点评 本题考查了常见化学用语的表示方法,题目难度不大,涉及原子符号、水解离子方程式、电离方程式、结构式等知识,明确常见化学用语的书写原则为解答关键,试题培养了学生的规范答题能力.

练习册系列答案
相关题目
7.化学与生活密切相关.下列有关说法错误的是( )
| A. | SO2和NO2是主要的大气污染物 | |
| B. | 大气中的SO2和CO2溶于水形成酸雨 | |
| C. | 以液化石油气代替燃油可减少大气污染 | |
| D. | 对煤燃烧后形成的烟气脱硫,目前主要用石灰法 |
13.25℃时,有关物质的电离平衡常数如表:
(1)电解质由强至弱顺序为H2SO3>CH3COOH>H2CO3(用化学式表示,下同).
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为CO32->SO32->CH3COO->HSO3-.
(4)NaHSO3溶液显酸性的原因HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-).
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为CO32->SO32->CH3COO->HSO3-.
(4)NaHSO3溶液显酸性的原因HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-).
20.近年来高铁酸钾(K2FeO4)已经被广泛应用在水处理方面,高铁酸钾的氧化性超过高锰酸钾,是一种集氧化、吸附、凝聚、杀菌于一体的新型高效多功能水处理剂.干燥的高铁酸钾受热易分解,但在198℃以下是稳定的.高铁酸钾在水处理过程中涉及的变化过程有( )
①胶体的吸附 ②盐类水解 ③焰色反应 ④氧化还原反应.
①胶体的吸附 ②盐类水解 ③焰色反应 ④氧化还原反应.
| A. | ①②③④ | B. | ①②④ | C. | ②③④ | D. | ①③④ |
17.在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量QkJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
15.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
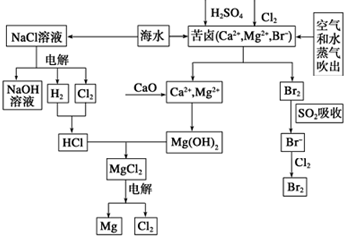 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题: .
. .
.