题目内容
6.目前有四个实验方案,可行的是( )| A. | 除去混在Cu粉中的少量Mg粉和Al粉,加稀盐酸后过滤 | |
| B. | 分离汽油和煤油,可用萃取的方法 | |
| C. | 分离硝酸钾和氯化钠固体的混合物,可用溶解、过滤的方法 | |
| D. | 将氧气和氢气的混合气体通过灼热的氧化铜,以除去其中的氢气 |
分析 A.Mg、Al均与盐酸反应,而Cu不反应;
B.汽油和煤油互溶,但沸点不同;
C.二者溶解度受温度影响不同;
D.氢气还原CuO,但生成的Cu与氧气反应.
解答 解:A.Mg、Al均与盐酸反应,而Cu不反应,则与足量盐酸反应后过滤可分离,故A正确;
B.汽油和煤油互溶,但沸点不同,不能萃取分离,应选蒸馏法,故B错误;
C.二者溶解度受温度影响不同,则选结晶法、过滤分离,故C错误;
D.氢气还原CuO,但生成的Cu与氧气反应,不能利用灼热的CuO除杂,故D错误;
故选A.
点评 本题考查化学实验方案的评价,为高频考点,把握物质的性质、发生的反应、混合物分离提纯、实验技能为解答的关键,侧重分析与实验能力的考查,注意元素化合物知识与实验的结合,题目难度不大.

练习册系列答案
相关题目
17.在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量QkJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
1.实验室有一包白色固体,可能含有硫酸铵、硫酸氢氨中的一种或两种,为确定其成分,现称取24.70g的白色固体溶于适量水中,然后滴加4mol•L-1的氢氧化钠溶液50.00mL,加热(此温度下铵盐不分解)充分反应使氨气全部逸出,测得氨气在标况下的体积为2.24L,则下列表述正确的是( )
| A. | 白色固体一定只含有硫酸铵 | |
| B. | 若氢氧化钠溶液足量,则生成氨气的体积应为6.72L(标况) | |
| C. | 从上述数据能求算出白色固体中(NH4)2SO4、NH4HSO4的物质的量之比为1:2 | |
| D. | 将某白色固体加热分解,若产生的气体不能使湿润的红色石蕊试纸变蓝,则该固体中一定不含铵盐 |
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 反应KClO3+6HCl═3C12↑+KCl+3H2O,每生成1.5molC12转移电子数为2.5NA | |
| B. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | 1L0.1mol/LNH4Cl溶液中NH4+的数目为0.1NA | |
| D. | 40gSiC中含有Si-C键的数目为2NA |
18.有关苯酚的下列叙述中,错误的是( )
| A. | 纯净的苯酚是粉红色的晶体,65℃以上时能与水互溶 | |
| B. | 苯酚是生产电木的单体之一,与甲醛发生缩聚反应 | |
| C. | 苯酚比苯更易发生苯环上的取代反应 | |
| D. | 苯酚有毒,也能配制洗涤剂和软药膏 |
15.草酸与高锰酸钾在酸性条件下能够发生如下反应:MnO4-+H2C2O4+H+→Mn2++CO2↑+H2O(未配平)
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
(1)该反应中氧化剂和还原剂的物质的量之比为2:5.
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
用4mL0.001mol•L-1KMnO4溶液与2mL0.01mol•L-1H2C2O4溶液,研究反应的温度、反应物的浓度与催化剂等因素对化学反应速率的影响.改变的条件如表所示:
| 组别 | 10%硫酸体积/mL | 温度/℃ | 其他物质 |
| Ⅰ | 2 | 20 | |
| Ⅱ | 2 | 20 | 10滴饱和MnSO4溶液 |
| Ⅲ | 2 | 30 | |
| Ⅳ | 1 | 20 | 1mL蒸馏水 |
(2)实验Ⅰ和Ⅱ可得出的结论:影响化学反应速率的因素是催化剂;如果研究温度对化学反应速率的影响,使用实验Ⅰ和Ⅲ(Ⅰ~Ⅳ表示).
(3)实验Ⅳ中加入1mL蒸馏水的目的是确保所有实验中c(KMnO4)、c(H2C2O4)不变和总体积不变,实验Ⅳ中c(H+)不同.
5.一定条件下,一种反应物过量,另一种反应物仍不能完全反应的是( )
| A. | 过量的氢气与氧气 | B. | 过量的浓盐酸与二氧化锰 | ||
| C. | 过量的铜与浓硫酸 | D. | 过量的锌与18 mol/L硫酸 |
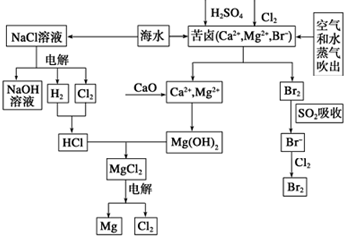 海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题:
海水是宝贵的资源宝库,目前氯碱工业、海水提镁、海水提溴为人类提供了大量工业原料.下图是海水综合利用的部分流程图,据图回答问题: