题目内容
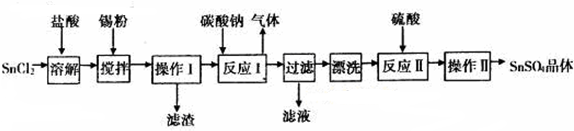
2.下列说法正确的是( )| A. | 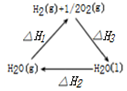 图表示:△H1=△H2+△H3 | |
| B. | 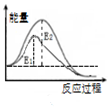 图表示:某反应在不用与用催化剂时,其反应活化能分别是E1和E2 | |
| C. |  图表示:H2(g)+Cl2(g)=2HCl(g)△H=-183kJ/mol | |
| D. | 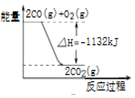 图表示:CO的燃烧热为1132KJ/mol |
分析 A.反应一步完成与分步完成,热效应相同;
B.使用催化剂降低反应的活化能;
C.由图可知,反应物的总能量大于生成物的总能量,放热反应;
D.燃烧热为1molCO燃烧时的热量变化,而图中为2molCO燃烧的热量变化.
解答 解:A.反应一步完成与分步完成,热效应相同,由图可知-△H1=△H2+△H3,故A错误;
B.使用催化剂降低反应的活化能,则E1为使用催化剂时的活化能,故B错误;
C.由图可知,反应物的总能量大于生成物的总能量,放热反应,可知H2(g)+Cl2(g)=2HCl(g)△H=(679-862)kJ/mol=-183kJ/mol,故C正确;
D.燃烧热为1molCO燃烧时的热量变化,而图中为2molCO燃烧的热量变化,则CO的燃烧热为566KJ/mol,故D错误;
故选C.
点评 本题考查反应热与焓变,为高频考点,把握反应中能量变化、盖斯定律应用、燃烧热为解答的关键,侧重分析与应用能力的考查,注意图象的分析,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
13.25℃时,有关物质的电离平衡常数如表:
(1)电解质由强至弱顺序为H2SO3>CH3COOH>H2CO3(用化学式表示,下同).
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为CO32->SO32->CH3COO->HSO3-.
(4)NaHSO3溶液显酸性的原因HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-).
| 化学式 | CH3COOH | H2CO3 | H2SO3 |
| 电离平衡常数K | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(2)常温下,0.02mol•L-1的CH3COOH溶液的电离度约为3%,体积为10mLpH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者<后者(填“>”、“<”或“=”).
(3)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的顺序为CO32->SO32->CH3COO->HSO3-.
(4)NaHSO3溶液显酸性的原因HSO3-?H++SO32-,HSO3-+H2O?H2SO3+OH-,HSO3-的电离程度大于其水解程度,所以NaHSO3溶液显酸性(离子方程式配适当文字叙述),其溶液中离子浓度由大到小的关系是C(Na+)>C(HSO3-)>C(H+)>C(SO32-)>C(OH-).
17.在常温常压时,充分燃烧一定量的丁烷(C4H10)气体,放出热量QkJ(Q>0),将生成的二氧化碳全部通入足量NaOH溶液中,发生的反应为:CO2+2NaOH=Na2CO3+H2O,共消耗了4mol•L-1的NaOH溶液200mL.则此条件下,下列热化学方程式正确的是( )
| A. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-QkJ•mol-1 | |
| B. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=-10QkJ•mol-1 | |
| C. | C4H10(g)+O2(g)═4CO2(g)+5H2O(l)△H=+10QkJ•mol-1 | |
| D. | C4H10(g)+O2(g)═4CO2(g)+5H2O(g)△H=-10QkJ |
7.下列有关叙述正确的是( )
| A. | 金属元素的原子只有还原性,其阳离子只有氧化性 | |
| B. | O2与O3互为同位素,相互转化为化学变化 | |
| C. | 1H 2H 3H互为同位素,其性质相似 | |
| D. | 金属阳离子被还原不一定得到金属单质 |
11.设NA为阿伏伽德罗常数的值,下列说法正确的是( )
| A. | 反应KClO3+6HCl═3C12↑+KCl+3H2O,每生成1.5molC12转移电子数为2.5NA | |
| B. | 标准状况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA | |
| C. | 1L0.1mol/LNH4Cl溶液中NH4+的数目为0.1NA | |
| D. | 40gSiC中含有Si-C键的数目为2NA |
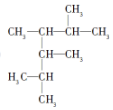 2,3,4,5-四甲基己烷
2,3,4,5-四甲基己烷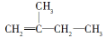 2-甲基-1-丁烯
2-甲基-1-丁烯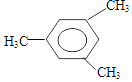 .
. .
. .
.