题目内容
7.下列说法中,正确的是( )| A. | 1 mol CO2的质量是44g | |
| B. | 17 g NH3的体积是22.4 L | |
| C. | 100 mL 1 mol/L NaOH溶液中含有1 mol OH- | |
| D. | 标准状况下,11.2 L O2中含有6.02×1023个氧分子 |
分析 A.根据m=nM计算;
B.没有说明是否是标准状况;
C.根据n=cV计算;
D.根据n=$\frac{V}{{V}_{m}}$,N=nNA计算.
解答 解:A.1 mol CO2的质量是m=nM=1mol×44g/mol=44g,故A正确;
B.没有说明是否是标准状况,所以无法计算气体的体积,故B错误;
C.100 mL 1 mol/L NaOH溶液中含有OH-的物质的量为0.1L×1mol/L=0.1mol,故C错误;
D.标准状况下,11.2 L O2的物质的量为0.5mol,则含有3.01×1023个氧分子,故D错误.
故选A.
点评 本题考查了物质的量的有关计算,明确各个物理量之间的关系是解本题关键,根据公式来分析解答即可,难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
17.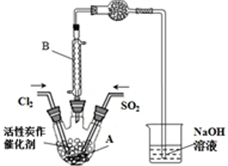 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
SO2Cl2(l)+SCl2(g)?2SOCl2(g)△H=﹢b kJ•mol-1
(1)则反应:SO2(g)+Cl2(g)+SO2?Cl2(l)△H=(-a-b)kJ•mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K=$\frac{c(S{O}_{2}C{l}_{2})}{c(S{O}_{2})c(C{l}_{2})}$
(2)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g),设计制备磺酰氯的装置如图,有关信息如表所示.
①B仪器在本实验中的作用是冷凝SO2Cl2(或使挥发的产物SO2Cl2冷凝);由此可见该反应为放(填“吸”或“放”)热反应,干燥管的作用是防止水蒸气进入A与SO2Cl2发生水解反应,吸收SO2和Cl2气体,防止污染空气
②若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
③为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择B;实验结束后,将A中混合物分离开的最好方法是G.
A.常温 B.冰水浴 C.加热至69.1℃D.沸水浴
E.过滤 F.萃取 G.蒸馏 H.重结晶
④分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写SO2Cl2与NaOH溶液反应的化学方程式SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O
⑤若反应中消耗的氯气的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为61.1%(保留三位有效数字).
 已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1
已知:SO2(g)+Cl2(g)+SCl2(g)?2SOCl2(g)△H=-a kJ•mol-1SO2Cl2(l)+SCl2(g)?2SOCl2(g)△H=﹢b kJ•mol-1
(1)则反应:SO2(g)+Cl2(g)+SO2?Cl2(l)△H=(-a-b)kJ•mol-1(用含a、b的代数式表示);该反应平衡常数表达式为K=$\frac{c(S{O}_{2}C{l}_{2})}{c(S{O}_{2})c(C{l}_{2})}$
(2)磺酰氯(SO2Cl2)是一种有机氯化剂,也是锂电池正极活性物质.
某学习小组依据反应:SO2(g)+Cl2(g)?SO2Cl2(g),设计制备磺酰氯的装置如图,有关信息如表所示.
| SO2Cl2 | Cl2 | SO2 | |
| 熔点/℃ | -54.1 | -101 | -72.4 |
| 沸点/℃ | 69.1 | -34.6 | -10 |
| 性质 | 遇水发生剧烈水解 | / | / |
②若用浓盐酸与高锰酸钾为原料制取Cl2,则反应的离子方程式为2MnO4-+16H++10Cl-=2Mn2++5Cl2↑+8H2O;
③为了便于混合物的分离且提高反应物的转化率,A装置的反应条件最好选择B;实验结束后,将A中混合物分离开的最好方法是G.
A.常温 B.冰水浴 C.加热至69.1℃D.沸水浴
E.过滤 F.萃取 G.蒸馏 H.重结晶
④分离产物后,向获得的SO2Cl2中加水,出现白雾,振荡、静置得到无色溶液.
经分析SO2Cl2与H2O反应属于非氧化还原反应,写SO2Cl2与NaOH溶液反应的化学方程式SO2Cl2+4NaOH=Na2SO4+2NaCl+2H2O
⑤若反应中消耗的氯气的体积为896mL(已转化为标准状况,SO2足量),最后得到纯净的磺酰氧3.3g,则磺酰氯的产率为61.1%(保留三位有效数字).
15.下列元素中,原子半径最大的是( )
| A. | Na | B. | Al | C. | P | D. | S |
2.下列物质的电子式书写正确的是( )
| A. | H:H | B. | 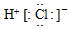 | C. | 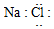 | D. | 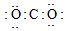 |
16.下列离子方程式中,书写正确的是( )
| A. | 氢氧化镁溶于盐酸:OH-+H+═H2O | |
| B. | 铜片插入硝酸银溶液中:Cu+Ag+═Ag++Cu2+ | |
| C. | 将稀硫酸加入氢氧化钡溶液:H++OH-═H2O | |
| D. | 碳酸钠溶液与稀硫酸混合:CO32-+2H+═CO2↑+H2O |
 ;与E同周期的元素中,金属性最弱的金属元素名称是铝,最稳定的气态氢化物的化学式为HCl;
;与E同周期的元素中,金属性最弱的金属元素名称是铝,最稳定的气态氢化物的化学式为HCl; ,B与D通常能形成共价(填“离子”或“共价”)化合物,在E2D2中含有的化学键有离子键、非极性共价键.
,B与D通常能形成共价(填“离子”或“共价”)化合物,在E2D2中含有的化学键有离子键、非极性共价键.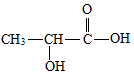 乳酸是世界上公认的三大有机酸之一,其应用非常广泛,可用作食品酸味剂、医药防腐剂、工业pH调节剂等.乳酸的结构简式如图所示.
乳酸是世界上公认的三大有机酸之一,其应用非常广泛,可用作食品酸味剂、医药防腐剂、工业pH调节剂等.乳酸的结构简式如图所示.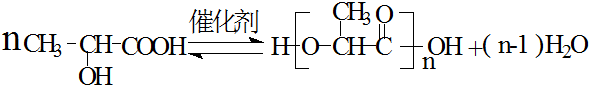 .
.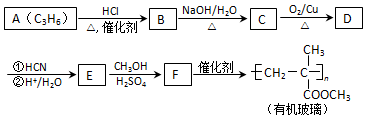
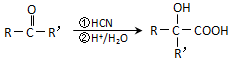 (注:R′可以是烃基,也可以是H原子)
(注:R′可以是烃基,也可以是H原子)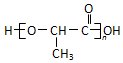 )是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线
)是一种生物可降解材料,参考上述信息设计由乙醇制备聚乳酸的合成路线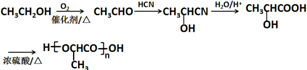 .(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)
.(示例:反应条件X$\stackrel{反应条件1}{→}$Y$\stackrel{反应条件2}{→}$Z …)