题目内容
7.某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )| A. | Fe2+、Cl-、Na+、NO3- | B. | K+ Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Na+、K+、[Al(OH)4]-、SO42- |
分析 某无色溶液能溶解Al(OH)3,为酸或强碱溶液,根据离子之间不能结合生成沉淀、气体、水等,不能发生氧化还原反应,则离子大量共存,并结合离子的颜色来解答.
解答 解:某无色溶液能溶解Al(OH)3,为酸或强碱溶液,
A.强碱溶液中不能大量存在Fe2+,且Fe2+为浅绿色,与无色不符,故A不选;
B.HCO3-与酸、碱均反应,不能大量共存,故B不选;
C.酸碱溶液中该组离子之间不反应,可大量共存,且离子均为无色,故C选;
D.酸溶液中不能大量存在[Al(OH)4]-,故D不选;
故选C.
点评 本题考查离子的共存,为高频考点,把握常见离子之间的反应为解答的关键,侧重分析与应用能力的考查,注意复分解反应的判断,题目难度不大.

练习册系列答案
相关题目
18.下列说法中正确的是( )
| A. | 乙烷和氯气按1:1混合,在光照下发生取代反应时,有机产物只有一种 | |
| B. | 在氧气中燃烧时只生成CO2和H2O的物质一定是烃 | |
| C. | 乙酸是有机弱酸,所以它的酸性比碳酸弱 | |
| D. | 在酯化反应中,羧酸脱去羧基中的羟基,醇脱去羟基中的氢而生成酯 |
15.随着手机、手提电脑、数码相机等电器的普及,锂电池的生产量和消费量大.造成资源短缺,钴的毒性又很大.因此,回收锂电池既有较大的经济价值,又有益于保护生态环境.某课题小组提出如下方案对某钴酸锂正极材料(主要含LiCoO2、铝箔、性质稳定的导电剂等)进行回收钴等金属.
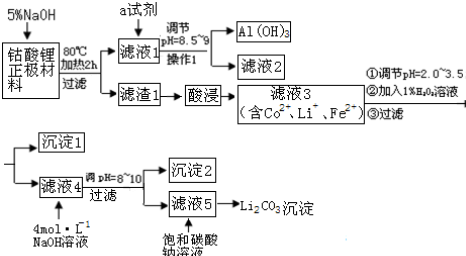
已知:金属氢氧化物沉淀的pH值
回答下列问题:
(1)写出钴酸锂正极材料用加5%氢氧化钠溶液,发生的离子反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)操作1所用到的玻璃仪器除烧杯、漏斗外,还必须有玻璃棒(填仪器名称).
(3)滤液4到沉淀2可以选择抽滤,抽滤不仅能加快过滤速度,而且能得到比较干燥的晶体.但是,太细的晶体不适合于抽滤.一般情况下,下列哪些因素有利于得到较大的晶体AC.(填写序号)
A.缓慢冷却溶液B.溶质溶解度较小
C.缓慢蒸发溶剂 D.溶液浓度较高
(4)该课题组同学将滤渣1酸浸溶解得到Co2+用盐酸进行溶解.发生如下反应:
2LiCoO2+8HCl═2CoCl2+Cl2+2LiCl+4H2O
在此反应中,体现了盐酸的酸性和还原性.
指导老师建议采用稀硫酸和H2O2溶液溶解,发生如下反应:
2LiCoO2+□+6H++1H2O2=2Co2++1O2↑+2Li++4□
在上述方程式的□中填上缺少的微粒,并进行配平.
你认为指导老师提出该建议的主要依据是用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦
(5)试剂a最好选用下列试剂中的C
A.NaOH溶液 B.(NH4)2CO3溶液 C.NH4HCO3
(6)沉淀2的化学式是Co(OH)2.

已知:金属氢氧化物沉淀的pH值
| 金属氢氧化物 | 金属离子浓度 1mol•L-1 | 金属离子浓度 0.1mol•L-1 | 沉淀完全时的pH值 | |
| 分子式 | Ksp | 开始沉淀时的pH | ||
| Fe(OH)2 | 4.87×10-17 | 5.8 | 6.3 | 8.3 |
| Fe(OH)3 | 2.79×10-39 | 1.2 | 1.5 | 2.8 |
| Co(OH)2 | 5.92×10-15 | 6.9 | 7.4 | 9.4 |
(1)写出钴酸锂正极材料用加5%氢氧化钠溶液,发生的离子反应方程式2Al+2OH-+2H2O=2AlO2-+3H2↑
(2)操作1所用到的玻璃仪器除烧杯、漏斗外,还必须有玻璃棒(填仪器名称).
(3)滤液4到沉淀2可以选择抽滤,抽滤不仅能加快过滤速度,而且能得到比较干燥的晶体.但是,太细的晶体不适合于抽滤.一般情况下,下列哪些因素有利于得到较大的晶体AC.(填写序号)
A.缓慢冷却溶液B.溶质溶解度较小
C.缓慢蒸发溶剂 D.溶液浓度较高
(4)该课题组同学将滤渣1酸浸溶解得到Co2+用盐酸进行溶解.发生如下反应:
2LiCoO2+8HCl═2CoCl2+Cl2+2LiCl+4H2O
在此反应中,体现了盐酸的酸性和还原性.
指导老师建议采用稀硫酸和H2O2溶液溶解,发生如下反应:
2LiCoO2+□+6H++1H2O2=2Co2++1O2↑+2Li++4□
在上述方程式的□中填上缺少的微粒,并进行配平.
你认为指导老师提出该建议的主要依据是用盐酸溶解会产生有毒的氯气污染环境,同时为了除去溶液的Fe2+,还要再加H2O2,操作麻烦
(5)试剂a最好选用下列试剂中的C
A.NaOH溶液 B.(NH4)2CO3溶液 C.NH4HCO3
(6)沉淀2的化学式是Co(OH)2.
2.下列各组离子在溶液中能大量共存的是( )
| A. | Na+、H+、Ba2+、CO32- | B. | K+、Na+、Ag+、Cl- | ||
| C. | H+、Mg2+、HCO3-、SO42- | D. | Ba2+、Cl-、NO3-、OH- |
12.同温同压下,将一定量的硫化氢和二氧化硫混合后恰好完全反应,若反应中转移的电子是1mol,则在反应中生成的硫为( )
| A. | 1 mol | B. | 0.75 mol | C. | 0.5 mol | D. | 0.25 mol |
19.在100g浓度为18mol/L,密度为d g/cm3的浓硫酸中加入一定量的水稀释成9mol/L硫酸,则加入水的体积为( )
| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{d}$mL |