题目内容
19.在100g浓度为18mol/L,密度为d g/cm3的浓硫酸中加入一定量的水稀释成9mol/L硫酸,则加入水的体积为( )| A. | 小于100mL | B. | 等于100mL | C. | 大于100mL | D. | 等于$\frac{100}{d}$mL |
分析 根据稀释前后溶质的质量不变来列式计算,硫酸的物质的量浓度越大,密度越大,质量分数越大越大来分析,注意水的密度比硫酸的密度小.
解答 解:设浓硫酸的体积为VmL,根据稀释前后溶质的质量不变,设稀释后溶液的体积为x,
则:VmL×18mol/L=x×9mol/L,解得:x=2VmL,
硫酸溶液的浓度越大,密度越大,所以稀释后硫酸的密度小于d,故稀释后硫酸的质量小于2V×d(即200g),所以加入水的质量小于200g-100g=100g,
又水的密度约为1g/mL,则加水的体积小于100mL,
故选A.
点评 本题考查了物质的量浓度的有关计算,题目难度不大,明确硫酸溶液浓度与密度的关系为解答关键,注意掌握物质的量浓度的概念及表达式,试题侧重于分析能力和计算能力的考查.

练习册系列答案
相关题目
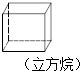
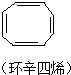
9.卤代烃能够发生下列反应:2CH3CH2Br+2Na→CH3CH2CH2CH3+2NaBr,下列有机物不可能合成环状烷的是( )
| A. | BrCH2CH2CH2CH2CH2Br | B. | 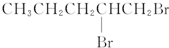 | ||
| C. | 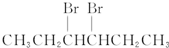 | D. | CH3CH2CH2CH2CH2Br |
7.某无色溶液能溶解Al(OH)3,则此溶液中一定能大量共存的离子组是( )
| A. | Fe2+、Cl-、Na+、NO3- | B. | K+ Na+、NO3-、HCO3- | ||
| C. | Na+、Ba2+、Cl-、NO3- | D. | Na+、K+、[Al(OH)4]-、SO42- |
4.具有下列电子排布式的原子中,半径最大的是( )
| A. | ls22s22p63s23p5 | B. | 1s22s22p3 | C. | 1s22s22p4 | D. | 1s22s22p63s23p3 |
11.下列属于吸热反应的是( )
| A. | 酸碱中和 | B. | 氢气燃烧 | ||
| C. | 浓硫酸的稀释 | D. | Ba(OH)2•8H2O和NH4Cl(固体)混合 |
8.下列物质中,酸性最强的是( )
| A. | H2SiO3 | B. | H3PO4 | C. | H2SO4 | D. | HClO |

 .
.