题目内容
11.下列说法正确的是( )| A. | 需要加热发生的反应一定是吸热反应 | |
| B. | 任何放热反应在常温下一定能发生 | |
| C. | 温度压强一定时,放热的、熵增加反应能自发进行 | |
| D. | 吸热反应一定是反应物总能量大于生成物的总能量 |
分析 A、很多放热反应需要加热才能发生;
B、放热反应在常温下不一定能发生;
C、反应方向的判据是△G=△H-T△S,△G>0反应不能自发进行,△G<0反应能自发进行,△G=0达到平衡;
D、吸热反应中,反应物的总能量小于生成物的总能量.
解答 解:A、很多放热反应需要加热才能发生,如煤炭的燃烧是放热反应,但需要加热才能发生,故A错误;
B、放热反应在常温下不一定能发生,如煤炭的燃烧,在常温下不加热的话则不能进行,故B错误;
C、放热反应△H<0,熵增加的反应,△S>0,△H-T△S一定小于0,反应一定能自发进行,故C正确;
D、吸热反应中,反应物的总能量小于生成物的总能量,当反应物的总能量大于生成物的总能量时,反应放热,故D错误.
故选C.
点评 本题考查了化学反应能否自发进行的判断和反应条件与反应吸放热的关系,题目比较简单,注意化学反应的方向是熵变和焓变共同影响的结果,根据公式判断.

练习册系列答案
相关题目
2.同周期的X、Y、Z三元素,已知其最高价氧化物对应的水化物的酸性强弱顺序是:HXO4>H2YO4>H3ZO4,则下列各判断中正确的是( )
| A. | 原子半径:X>Y>Z | |
| B. | 非金属性:X>Y>Z | |
| C. | 阴离子的还原性按X、Y、Z的顺序由强到弱 | |
| D. | 气态氢化物的稳定性按X、Y、Z的顺序由弱到强 |
19.在0.1mol•L-1NH3•H2O溶液中存在如下电离平衡:NH3•H2O?NH4++OH-.对于该平衡,下列叙述中正确的是( )
| A. | 降低温度,溶液中c(NH4+)增大 | |
| B. | 加入水时,溶液中$\frac{c(O{H}^{-})}{c(N{H}_{3}•{H}_{2}O)}$ 增大 | |
| C. | 加入水时,溶液中c(H+)减小 | |
| D. | 加入少量NaOH固体,平衡向逆反应方向移动,溶液中c(OH-)减小 |
16.0.1mol•L-1的盐酸溶液与0.1mol•L-1的氨水等体积混合,溶液中离子浓度关系正确的是( )
| A. | c(NH4+)=c(Cl-)>c(H+)=c(OH-) | B. | c(NH4+)>c(Cl-)>c(OH-)>c(H+) | ||
| C. | c(Cl-)>c(NH4+)>c(H+)>c(OH-) | D. | c(Cl-)>c(NH4+)>c(OH-)>c(H+) |
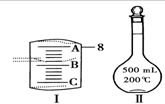 实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题:
实验室要用Na2CO3•10H2O晶体配制500mLO.1mol•L-1Na2CO3溶液,回答下列问题: