题目内容
下列离子方程式书写正确的是( )
| A、钠与水反应:Na+H2O=Na++OH-+H2↑ |
| B、氢氧化铜加到醋酸溶液中:Cu(OH)2+2H+=Cu2++2H2O |
| C、金属铁与稀硫酸反应:2Fe+6H+=2Fe3++3H2↑ |
| D、铜跟FeCl3溶液反应:Cu+2Fe3+=Cu2++2Fe2+ |
考点:离子方程式的书写
专题:
分析:A.该反应中原子不守恒、转移电子不守恒;
B.醋酸是弱电解质应该写化学式;
C.稀硫酸具有弱氧化性,能将铁氧化为亚铁离子;
D.氯化铁具有氧化性,能将Cu氧化为铜离子,自身被还原生成亚铁离子.
B.醋酸是弱电解质应该写化学式;
C.稀硫酸具有弱氧化性,能将铁氧化为亚铁离子;
D.氯化铁具有氧化性,能将Cu氧化为铜离子,自身被还原生成亚铁离子.
解答:
解:A.该反应中原子不守恒、转移电子不守恒,离子方程式为2Na+2H2O=2Na++2OH-+H2↑,故A错误;
B.醋酸是弱电解质应该写化学式,离子方程式为Cu(OH)2+2CH3COOH=2CH3COO-+Cu2++2H2O,故B错误;
C.稀硫酸具有弱氧化性,能将铁氧化为亚铁离子,离子方程式为Fe+2H+=Fe2++H2↑,故C错误;
D.氯化铁具有氧化性,能将Cu氧化为铜离子,自身被还原生成亚铁离子,离子方程式为Cu+2Fe3+=Cu2++2Fe2+,故D正确;
故选D.
B.醋酸是弱电解质应该写化学式,离子方程式为Cu(OH)2+2CH3COOH=2CH3COO-+Cu2++2H2O,故B错误;
C.稀硫酸具有弱氧化性,能将铁氧化为亚铁离子,离子方程式为Fe+2H+=Fe2++H2↑,故C错误;
D.氯化铁具有氧化性,能将Cu氧化为铜离子,自身被还原生成亚铁离子,离子方程式为Cu+2Fe3+=Cu2++2Fe2+,故D正确;
故选D.
点评:本题考查离子方程式正误判断,为高考高频点,明确离子反应条件及离子性质是解本题关键,离子方程式要遵循客观事实、原子守恒、电荷守恒及转移电子守恒,题目难度不大.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
X、Y、Z、W均为常见的烃的含氧衍生物且物质类别不同,存在如图所示的转化关系,则以下判断正确的是( )

| A、X是羧酸,Y是酯 |
| B、Z是醛,W是羧酸 |
| C、Y是醛,W是醇 |
| D、X是醇,Z是酯 |
几种短周期元素的原子半径及主要化合价见表,下列叙述正确的是( )
| 元素代号 | K | L | M | Q | R | T | N |
| 原子半径/nm | 0.186 | 0.160 | 0.143 | 0.102 | 0.089 | 0.074 | 0.152 |
| 主要化合价 | +1 | +2 | +3 | +6、-2 | +2 | -2 | +1 |
| A、在RCl2中,各原子最外层均满足8电子的稳定结构 |
| B、元素L和N性质相似因为处于同一主族 |
| C、K、M、Q三元素最高价氧化物对应的水化物两两之间可发生化学反应 |
| D、氢化物沸点:H2Q>H2T |
分子式为C5H10O3的有机物,在一定条件下能发生如下反应:①在浓硫酸存在下,能分别与CH3CH2OH或CH3COOH反应;②在特定温度及浓硫酸存在下,能生成一种能使溴水褪色的物质;③在特定温度及浓硫酸存在下,还能生成一种分子式为C5H8O2的五元环状化合物.则C5H10O3的结构简式为( )
| A、HOCH2CH2COOCH2CH3 |
| B、HOCH2CH2CH2CH2COOH |
| C、CH3CH2CH(OH)CH2COOH |
| D、CH3CH(OH)CH2CH2COOH |
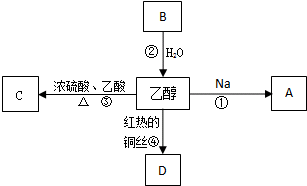 2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.
2011年5月1日起,《中华人民共和国刑法修正案(八)》正式实施,醉酒驾驶作为危险驾驶罪被追究驾驶人刑事责任.醉酒驾驶的界定标准为:每百毫升血液中的酒精含量高于或等于80毫克,相当于3两低度白酒或者2瓶啤酒.乙醇是生活中常见的有机物,能进行如图所示的多种反应,A、B、C、D都是含碳化合物,其中B是烃.