题目内容
19.主族元素A、B、C、D都属于短周期元素,A与D同主族,B与C在同一周期,A、D原子的最外层电子数都是1,C原子最外层电子数比B原子少2个,且C最外层电子数是次外层电子数的2倍.A、B单质在常温下均为气体,它们在高温下以体积比2:1完全反应,生成物在常温下是液体M.此液体与D单质能剧烈反应生成A的单质.所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子.回答下列问题:(1)写出B的单核阴离子结构示意图
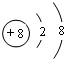 .
.(2)A、B单质在高温下反应生成的液体M的结构式H-O-H,写出C在足量B单质中充分反应后生成物的电子式
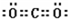 .
.(3)以C的一种单质为电极材料,写出用A、B的单质和KOH溶液构成的原电池的正、负极电极反应式,负极2H2-4e-+4OH-=4H2O,正极O2+4e-+2H2O=4OH-.
(4)写出B、D的单质在加热条件下形成化合物的电子式
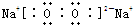 ,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程:
,其中含有的化学键有离子键、共价键.用电子式表示B、D的单质在常温下反应生成的化合物的形成过程: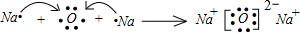 .
.
分析 主族元素A、B、C、D都属于短周期元素,C最外层电子数是次外层电子数的2倍,则C元素原子有2个电子层,最外层电子数为4,则C为碳元素;B与C在同一周期,C原子最外层电子数比B原子少2个,则B元素原子最外层电子数为6,则B为氧元素;A与D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,A单质在常温下为气体,则A为氢元素,氢气与氧气在高温下以体积比2:1完全反应,生成物在常温下是液体为H2O,水与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子,则D为Na元素,据此进行解答.
解答 解:主族元素A、B、C、D都属于短周期元素,C最外层电子数是次外层电子数的2倍,则C元素原子有2个电子层,最外层电子数为4,则C为碳元素;B与C在同一周期,C原子最外层电子数比B原子少2个,则B元素原子最外层电子数为6,则B为氧元素;A与D同主族,A、D原子的最外层电子数都是1,处于ⅠA族,A单质在常温下为气体,则A为氢元素,氢气与氧气在高温下以体积比2:1完全反应,生成物在常温下是液体为H2O,水与D单质能激烈反应生成A的单质,所得溶液滴入酚酞显红色,同时溶液中含有与氖原子的电子层结构相同的阳离子,则D为Na元素,
(1)B阴离子为O2-,其离子结构示意图为: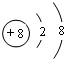 ,
,
故答案为: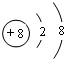 ;
;
(2)生成物在常温下是液体M为H2O,其结构式为:H-O-H;
C在足量的B中充分反应生成CO2,二氧化碳分子中含有两个碳氧双键,其电子式为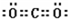 ,
,
故答案为:H-O-H;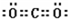 ;
;
(3)A、B的单质分别为氢气、氧气,用氢气、氧气和KOH溶液构成的原电池中,负极氢气失去电子结合氢氧根离子生成水,负极反应为:2H2-4e-+4OH-=4H2O;正极氧气得到电子生成氢氧根离子,正极反应为:O2+4e-+2H2O=4OH-,
故答案为:2H2-4e-+4OH-=4H2O;O2+4e-+2H2O=4OH-;
(4)B、D在加热条件下形成化合物为Na2O2,其电子式为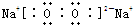 ,含有离子键、共价键,
,含有离子键、共价键,
B、D在不加热条件下形成化合物为Na2O,用电子式表示Na2O的形成过程: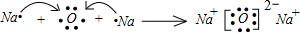 ,
,
故答案为: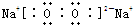 ;离子键、共价键;
;离子键、共价键;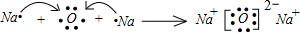 .
.
点评 本题考查了位置、结构与性质的关系及其应用,题目难度中等,涉及电子式、结构式、化学键、离子结构示意图等知识,推断元素为解答关键,注意掌握原子结构与元素周期律、元素周期表的关系.

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案| A. |  | B. |  | C. |  | D. |  |
| A. | 1molS的质量是32g/mol | B. | 27g铝的物质的量为1 | ||
| C. | CO的摩尔质量为28g/mol | D. | 2H2O的摩尔质量为18g/mol |
| B | ||
| A | X | C |
| D |
A:硅,B:氮,C:硫,D:砷.
(2)C、D、X最高价氧化物对应水化物酸性由强到弱的顺序:(填化学式)H2SO4>H3PO4>H3ASO4
(3)写出A、B、X气态氢化物的化学式,并排列稳定性由强到弱的顺序:NH3>PH3>SiH4.
(4)下列关于D元素化合物的性质叙述中不正确的是C
A.D的单质在通常状况下是固体
B.D难以与H2化合生成氢化物
C.气态氢化物有两种,为DH3和DH5.
| C | ||
| A | R | B |
| D |
| A. | 4 Z | B. | 4 Z+10 | C. | 4 Z+5 | D. | 4 Z+14 |
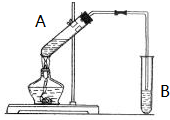 实验室用如图所示的装置制取乙酸乙酯.
实验室用如图所示的装置制取乙酸乙酯. CH3COOC2H5+H2O.
CH3COOC2H5+H2O.