题目内容
12.下列说法中错误的是( )| A. | 根据对角线规则,铍和铝的性质具有相似性 | |
| B. | 在H3O+、NH4+和[Cu(NH3)4]2+中都存在配位键 | |
| C. | O3与SO2的结构相似 | |
| D. | P4和CH4都是正四面体分子且键角都为109°28ˊ |
分析 A、铍和铝处于对角线上,所以铍和铝的性质具有相似性;
B、在物质或离子中中心原子含有空轨道,和含有孤电子对的原子或离子能形成配位键;
C、原子总数相同、电子总数或价电子总数相同的互为等电子体,等电子体的结构相似、物理性质相似,根据等电子体的概念分析解答;
D、P4是内空的正四面体,键角60°,而CH4是五原子形成的正四面体.
解答 解:A、铍和铝处于对角线上,根据对角线规则,所以铍和铝的性质具有相似性,故A正确;
B、H3O+氧提供孤电子对,氢离子提供空轨道形成配位键,NH4+氧原子提供孤电子对,氢离子提供空轨道,和[Cu(NH3)4]2+中铜提供孤电子对,形成配位键,故B正确;
C、SO2与O3中原子个数相等,电子总数不相同,但价电子总数相同,所以是等电子体,其空间构型相似,故C正确;
D、P4是内空的正四面体,分子中键角60°,而CH4是五原子形成的正四面体,故D错误.
故选:BC.
点评 本题考查配位键的判断,明确配位键的形成是解本题关键,题目难度中等.注意配位键形成的条件,一方要提供空轨道,另一方提供孤电子对.

练习册系列答案
相关题目
3.NA代表阿伏加德罗常数的值,下列说法正确的是( )
| A. | 2.3 g钠由原子变成离子时,失去的电子数为1NA | |
| B. | 0.2NA个硫酸分子与19.6 g磷酸含有相同的氧原子数 | |
| C. | 28 g氮气所含原子数为NA | |
| D. | NA个氧分子与NA个氢分子的质量比为2:1 |
20.向含Fe2(SO4)3、CuCl2、H2SO4的混合溶液中投入足量的Fe粉,充分反应后,剩余的固体物质经干燥,称得其质量比加入的铁粉质量减轻16g,此时溶液中c(Fe2+)是原混合液中c(Cu2+)的3倍(反应前后体积没有变化),溶液中c(SO42-)与c(Cl-)之比是( )
| A. | 1:2 | B. | 2:1 | C. | 1:3 | D. | 1:1 |
7.常温下,相同pH的氢氧化钠和醋酸钠溶液加水稀释,溶液的pH随溶液体积变化的曲线如图所示,则下列叙述正确的是( )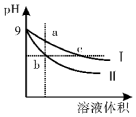

| A. | b、c两点溶液的导电能力b>c | |
| B. | 用等浓度的盐酸分别与等体积的b、c处溶液恰好完全反应,消耗盐酸体积Vb>Vc | |
| C. | c点溶液中c(H+)=c (OH-)+c(CH3COOH) | |
| D. | a、b、c三点溶液中水的电离程度a>c>b |
17.向20.0gCu 和Cu2S的混合物中加入某浓度的稀硝酸0.5L,固体物质完全反应,生成S单质、Cu(NO3)2和标准状况下4.48LNO.过滤后向所得溶液中加入1.0mol/L的NaOH溶液1.0L,金属离子完全沉淀,此时溶液呈中性.下列有关说法不正确的是( )
| A. | Cu与Cu2S的物质的量之比为10:1 | |
| B. | 硝酸的物质的量浓度为1.2mol/L | |
| C. | Cu(OH)2沉淀质量为29.4g | |
| D. | Cu、CuS与硝酸反应后剩余HNO3为0.4mol |
4.某化学小组研究盐酸被氧化的条件,进行如下实验.
(1)研究盐酸被MnO2氧化.
①已知MnO2呈弱碱性. I中溶液呈浅棕色是由于MnO2与浓盐酸发生了复分解反应,化学方程式是MnO2+4HCl═MnCl4+2H2O.
②II中发生了分解反应,反应的化学方程式是MnCl4═Cl2↑+MnCl2.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:
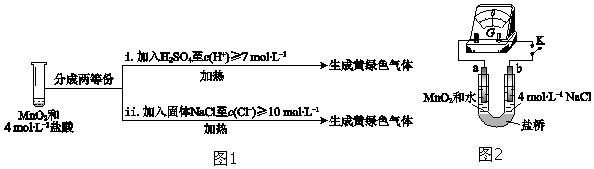
将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;将 i、ii作对比,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-).
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸不能(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
通过实验 I、II、III证明混合气体中含有Cl2,III的操作是将湿润的淀粉KI试纸伸入纯净的NO2中.
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)有关.
(1)研究盐酸被MnO2氧化.
| 实验 | 操作 | 现象 |
| I | 常温下将MnO2和12mol•L-1浓盐酸混合 | 溶液呈浅棕色,略有刺激性气味 |
| II | 将 I中混合物过滤,加热滤液 | 生成大量黄绿色气体 |
| III | 加热MnO2和4mol•L-1稀盐酸混合物 | 无明显现象 |
②II中发生了分解反应,反应的化学方程式是MnCl4═Cl2↑+MnCl2.
③III中无明显现象的原因,可能是c(H+)或c(Cl-)较低,设计实验(图1)IV进行探究:

将实验 III、IV作对比,得出的结论是III中没有明显现象的原因是c(H+)、c(Cl-)较低,需要增大到一定浓度才能被MnO2氧化;将 i、ii作对比,得出的结论是MnO2氧化盐酸的反应中c(H+)变化的影响大于c(Cl-).
④用图2装置(a、b均为石墨电极)进行实验 V:
ⅰ.K闭合时,指针向左偏转
ⅱ.向右管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针偏转幅度变化不大
ⅲ.再向左管中滴加浓H2SO4至c(H+)≥7mol•L-1,指针向左偏转幅度增大
将ⅰ和ⅱ、ⅲ作对比,得出的结论是HCl的还原性与c(H+)无关;MnO2的氧化性与c(H+)有关,c(H+)越大,MnO2的氧化性越强.
(2)研究盐酸能否被氧化性酸氧化.
①烧瓶中放入浓H2SO4,通过分液漏斗向烧瓶中滴加浓盐酸,烧瓶上方立即产生白雾,用湿润的淀粉KI试纸检验,无明显现象.由此得出浓硫酸不能(填“能”或“不能”)氧化盐酸.
②向试管中加入3mL浓盐酸,再加入1mL浓HNO3,试管内液体逐渐变为橙色,加热,产生棕黄色气体,经检验含有NO2.
| 实验 | 操作 | 现象 |
| I | 将湿润的淀粉KI试纸伸入棕黄色气体中 | 试纸先变蓝,后褪色 |
| II | 将湿润的淀粉KI试纸伸入纯净Cl2中 | 试纸先变蓝,后褪色 |
| III | … | … |
(3)由上述实验得出:盐酸能否被氧化与氧化剂的种类、c(Cl-)、c(H+)有关.
1.化学已经渗透到人类生活的方方面面.下列说法正确的是( )
| A. | “青蒿一握,以水二升渍,绞取汁”,该过程属于化学变化 | |
| B. | 去皮苹果放在空气中久置变黄与纸张久置变黄原理相似 | |
| C. | 高纯硅广泛用于制作光导纤维,光导纤维遇强碱会“断路” | |
| D. | 酸雨以及光化学烟雾的形成通常都与氮的含氧化合物有关 |
 阅读下列实验内容,根据题目要求回答问题.
阅读下列实验内容,根据题目要求回答问题.