题目内容
17.下列各组离子能在指定环境中大量共存的是( )| A. | 在 c(HCO3-)=0.1 mol•L-1 的溶液中:NH4+、AlO2-、Cl-、NO3- | |
| B. | 在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中:Cu2+、ClO-、Na+、SO42- | |
| C. | 在加入铝粉产生 H2 的溶液中:SO42-、NO3-、Na+、NH4+ | |
| D. | 在使红色石蕊试纸变蓝的溶液中:SiO32-、CO32-、Na+、F- |
分析 A.碳酸氢根离子的酸性大于氢氧化铝,碳酸氢根离子与偏铝酸根离子反应生成氢氧化铝沉淀;偏铝酸根离子与铵根离子发生双水解反应;
B.在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液中存在大量氢离子或氢氧根离子,铜离子与次氯酸根离子发生双水解反应,铜离子与氢氧根离子反应,次氯酸根离子与氢离子反应;
C.加入铝粉产生 H2 的溶液中存在大量氢离子或企业广告离子,铵根离子与氢氧根离子反应,硝酸根离子在酸性条件下与铝反应不会生成氢气;
D.使红色石蕊试纸变蓝的溶液中存在大量氢氧根离子,四种离子之间不反应,都不与氢氧根离子反应.
解答 解:A.NH4+、AlO2-之间发生双水解反应,HCO3-、AlO2-之间反应生成氢氧化铝沉淀和碳酸根离子,在溶液中不能大量共存,故A错误;
B.在由水电离出的 c(H+)=l×l0-12 mol•L-1 的溶液为酸性或碱性溶液,溶液中存在大量氢离子或氢氧根离子,Cu2+、ClO-之间发生双水解反应,Cu2+与氢氧根离子反应,ClO-与氢离子反应,在溶液中一定不能大量共存,故B错误;
C.加入铝粉产生 H2 的溶液为酸性或强碱性溶液,NH4+与强碱性溶液中的氢氧根离子反应,在酸性条件下NO3-具有强氧化性,与Al反应不会生成氢气,故C错误;
D.使红色石蕊试纸变蓝的溶液为碱性溶液,溶液中存在大量氢氧根离子,SiO32-、CO32-、Na+、F-之间不反应,都不与氢氧根离子反应,在溶液中能够大量共存,故D正确;
故选D.
点评 本题考查离子共存的判断,为高考的高频题,题目难度中等,注意明确离子不能大量共存的一般情况:能发生复分解反应的离子之间;能发生氧化还原反应的离子之间;能发生络合反应的离子之间(如 Fe3+和 SCN-)等;还应该注意题目所隐含的条件,如:溶液的酸碱性,据此来判断溶液中是否有大量的 H+或OH-;溶液的颜色,如无色时可排除 Cu2+、Fe2+、Fe3+、MnO4-等有色离子的存在;溶液的具体反应条件,如“氧化还原反应”、“加入铝粉产生氢气”等;试题有利于培养学生的逻辑推理能力,提高学生灵活运用基础知识解决实际问题的能力.

| A. | 天津港爆炸残留的剧毒物 NaCN,利用双氧水将其氧化为 NaHCO3 和 NH3降低毒性 | |
| B. | 氢氧化铁溶胶、水玻璃、淀粉溶液、PM2.5 微粒均具有丁达尔效应 | |
| C. | 二氧化硅不与任何酸反应,可用石英制造耐酸容器 | |
| D. | 氢氧化钠可作胃酸的中和剂 |
| 相关信息 | |
| X | 单质为双原子分子,在空气中所占体积约为78% |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为
 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.Ⅱ.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6 g 丙爆炸分生成H2和6.72L(标况下)X2,写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1则物质丁的化学式为H4H
Ⅲ.Z 的铁的化合物 FeZ3.在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+K1
Fe(OH)2++H2O?Fe(OH)2++H+K2
Fe(OH)++H2O?Fe(OH)3+H+K3
以上水解反应的平衡常数 K1、K2、K3 由大到小的顺序是K1>K2>K3.
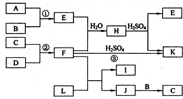 图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.
图是部分短周期元素的单质及其化合物的转化关系图(有关反应的条件及生成的H2O已略去),已知:(a)A、B、C、D是非金属单质,其中B、C、D在常温常压下是气体.(b)反应①、②是化工生产中的重要反应.(c)化合物E是形成酸雨的污染物之一,化合物K是常用的氮肥.(d)化合物L具有漂白性,可由Cl2与NaOH溶液反应而制得.(e)化合物J由两种元素组成,其相对分子质量为32.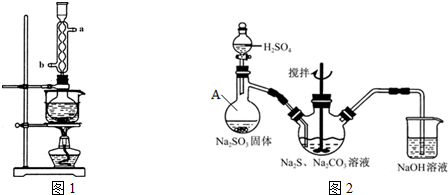
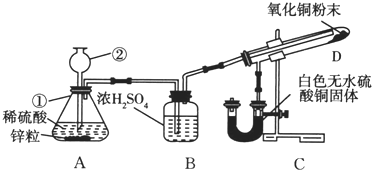 某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.
某学生为了验证氢气还原氧化铜的产物,设计了如图所示的实验装置.