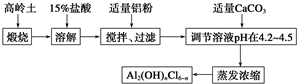
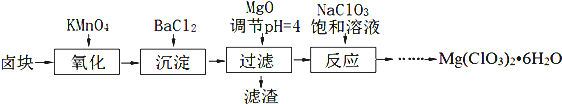
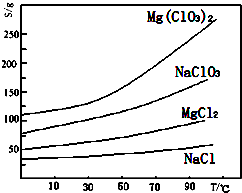
题目内容
10.25℃时,弱酸的电离平衡常数如下表,下列说法正确的是( )| 弱酸化学式 | CH3COOH | HCN | H2CO3 |
| 电离平衡常数(25℃) | 1.8×l0-5 | 4.9×l0-10 | K1=4.3×l0-7K2=5.6×l0-11 |
| A. | 向NaCN 溶液中通入少量CO2发生的离子反应为:2CN-+H2O+CO2═2HCN+CO32- | |
| B. | 等物质的量浓度的各溶液pH关系为:pH(NaCN)>pH(Na2CO3)>pH(CH3COONa) | |
| C. | a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),则b一定大 于a | |
| D. | NaHCO3和Na2CO3的混合溶液中,一定存在:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-) |
分析 根据表中数据可知溶液酸性:CH3COOH>H2CO3>HCN>HCO3-,酸越弱,对应的盐水解程度越大,溶液碱性越强,
A.酸性HCN>HCO3-,二氧化碳少量时生成HCN和碳酸氢根离子;
B.浓度相同时,对应酸的酸性越强,则酸根离子的水解程度越弱,溶液的pH越小;
C.c(Na+)>c(CN-),根据电荷守恒可知c(H+)<c(OH-),溶液呈碱性,b≥a时溶液越大呈碱性;
D.根据碳酸钠、碳酸氢钠混合液中的电荷守恒判断.
解答 解:根据表中数据可知溶液酸性:CH3COOH>H2CO3>HCN>HCO3-,
A.向NaCN溶液中通入少量CO2,由于酸性HCN>HCO3-,二氧化碳少量时生成HCN和HCO3-,正确的离子反应为:CN-+H2O+CO2═HCN+HCO3-,故A错误;
B.等物质的量浓度的各溶液,由于酸性CH3COOH>HCN>HCO3-,则盐的水解程度:Na2CO3>NaCN>CH3COONa,水解程度越大,溶液的pH越大,则pH关系为:pH(Na2CO3)>pH(NaCN)>pH(CH3COONa),故B错误;
C.a mol/LHCN溶液与b mol/LNaOH溶液等体积混合后,所得溶液中c(Na+)>c(CN-),根据电荷守恒可知c(H+)<c(OH-),溶液呈碱性,b≥a时溶液越大呈碱性,所以b不一定大于a,故C错误;
D.根据NaHCO3和Na2CO3的混合溶液中的核电荷数可得:c(Na+)+c(H+)=c(OH-)+c(HCO3-)+2c(CO32-),故D正确;
故选D.
点评 本题考查了离子浓度大小比较,题目难度中等,明确盐的水解原理及其影响为解答关键,注意掌握电荷守恒、物料守恒的含义及应用方法,试题培养了学生的分析能力及灵活应用能力.

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目
2.有X、Y、Z、R四种短周期主族元素,Y、Z、R同周期.相关信息如下:
Ⅰ.(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
Ⅱ.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6 g 丙爆炸分生成H2和6.72L(标况下)X2,写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1则物质丁的化学式为H4H
Ⅲ.Z 的铁的化合物 FeZ3.在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+K1
Fe(OH)2++H2O?Fe(OH)2++H+K2
Fe(OH)++H2O?Fe(OH)3+H+K3
以上水解反应的平衡常数 K1、K2、K3 由大到小的顺序是K1>K2>K3.
| 相关信息 | |
| X | 单质为双原子分子,在空气中所占体积约为78% |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为
 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.Ⅱ.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6 g 丙爆炸分生成H2和6.72L(标况下)X2,写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1则物质丁的化学式为H4H
Ⅲ.Z 的铁的化合物 FeZ3.在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+K1
Fe(OH)2++H2O?Fe(OH)2++H+K2
Fe(OH)++H2O?Fe(OH)3+H+K3
以上水解反应的平衡常数 K1、K2、K3 由大到小的顺序是K1>K2>K3.
19.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
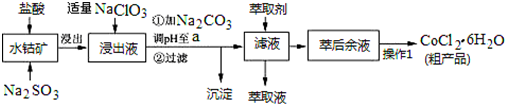
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含的基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤、减压烘干.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B..
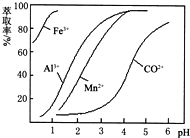
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含的基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤、减压烘干.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B..

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.
20.德国卡尔•肖莱马是有机化学的奠基人和杰出的有机化学理论家.他的主要贡献是对脂肪烃的系统研究并解决了烷烃的异构理论.根据下表中烃的分子式排列规律,判断空格中烃的同分异构体数目是( )
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 |
| CH4 | C2H4 | C3H8 | C4H8 | C6H12 | C7H16 | C8H16 |
| A. | 3 | B. | 4 | C. | 5 | D. | 6 |
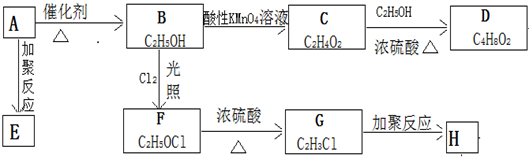
 ; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.
; ②C→D:CH3COOH+CH3CH2OH$?_{△}^{浓硫酸}$CH3COOCH2CH3+H2O.