题目内容
14.己知:KI溶液在酸性条件下能被空气中的O2氧化,反应的离子方程式为:O2+4I一+4H+=212+2H2O.(1)某化学小组为探究不同条件对上述反应速率的影响,设计如下实验,完成下表中①和②的内容.
(限选试剂:0.lmol/L硫酸、0.2mol/L硫酸、Imol/L KOH溶液、淀粉溶液)
| 组别 | 温度 | KI溶液 | H2SO4溶液 | 淀粉溶液 | 实验目的 | ||
| C(KI) | V | C(H2SO4) | V | ||||
| 1 | 298K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | l组和2组探究②温度对该反应速率的影响;1组和3组探究反应物浓度对该反应速率的影响 |
| 2 | 308K | 1mol/L | 5mL | 0.1mol/L | 5mL | 3滴 | |
| 3 | 298K | 1mol/L | 5mL | ①0.2mol/L硫酸 | 5mL | 3滴 | |
A.先将硫酸溶液与淀粉溶液混合,然后再加入KI溶液
B.先将KI溶液与硫酸溶液混合,然后再加入淀粉溶液
C.先将KI溶液与淀粉溶液混合,然后再加入硫酸溶液
(3)在实验中,发现露置在空气中的KI溶液逐渐变黄色.通过查阅资料知:KI溶液在空气中会生成I2和KOH.小组同学对该描述有疑问:I2为何能与KOH共存?为此提出下列假设进行探究:
假设一:常温下,I2和KOH不反应
假设二:溶液碱性弱,I2和KOH不反应
假设三:…
请设计实验验证假设二,完成表中的内容
| 实验方案 | 预期实验现象与结论 |
| 取少量碘水于试管中,滴入几滴淀粉 溶液,然后逐滴加入1mol/L KOH溶液,观察现象 | 若蓝色不褪色,则假设二正确 |
分析 (1)根据表格,对比①②的数据,可以看出实验①②是探究温度对反应速率的影响;实验①③是探究反应物浓度对该反应速率的影响,所以此时两个实验中H2SO4溶液应当不相等,据此答题;
(2)实验中应先向一定体积的KI溶液中滴加淀粉溶液,然后再加入稀硫酸,在酸性条件下发生氧化还原反应生成碘,应记录的数据为反应的时间;
(3)淀粉与碘水作用显蓝色,加入氢氧化钾,若蓝色不褪色,说明溶液中溶液碱性弱,I2和KOH不反应.
解答 解:(1)根据表格,对比①②的数据,可以看出温度不一样,其它条件都一样,所以实验①②是探究温度对反应速率的影响;实验①③是探究反应物浓度对该反应速率的影响,所以此时两个实验中H2SO4溶液应当不相等,所以选择0.2mol/L硫酸,
故答案为:0.2mol/L硫酸;温度;
(2)探究不同条件对O2+4I一+4H+=212+2H2O反应速率的影响,淀粉遇碘变蓝色,实验中应先向一定体积的KI溶液中滴加淀粉溶液,然后再加入稀硫酸,在酸性条件下发生氧化还原反应生成碘,可根据颜色的变化判断反应速率,应记录的内容是溶液从无色变为蓝色所需的时间,
故答案为:C;溶液从无色变为蓝色所需的时间;
(3)淀粉与碘水作用显蓝色,加入氢氧化钾,若蓝色不褪色,说明溶液中溶液I2和KOH不反应,即验证假设2碱性弱,I2和KOH不反应,
故答案为:碘水;1mol/L KOH溶液;蓝色不褪色.
点评 本题主要考查浓度、温度对反应速率的影响,对学生的分析能力和逻辑推理能力有一定的要求,题目难度中等.

练习册系列答案
相关题目
17.下列叙述中,不能用勒夏特列原理解释的是( )
| A. | 合成氨需用铁触媒加快反应速率 | |
| B. | 高压比常压有利于合成SO3的反应 | |
| C. | 由H2、I2(g)、HI(g)气体组成的平衡体系加压后颜色变深 | |
| D. | 收集氯气可用排饱和食盐水法 |
2.有X、Y、Z、R四种短周期主族元素,Y、Z、R同周期.相关信息如下:
Ⅰ.(1)Z元素在周期表的位置是第三周期第ⅦA族,Y、Z、R简单离子的半径从大到小的顺序是S2->Cl->Na+(用离子符号表示);
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为 ;
;
(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
Ⅱ.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6 g 丙爆炸分生成H2和6.72L(标况下)X2,写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1则物质丁的化学式为H4H
Ⅲ.Z 的铁的化合物 FeZ3.在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+K1
Fe(OH)2++H2O?Fe(OH)2++H+K2
Fe(OH)++H2O?Fe(OH)3+H+K3
以上水解反应的平衡常数 K1、K2、K3 由大到小的顺序是K1>K2>K3.
| 相关信息 | |
| X | 单质为双原子分子,在空气中所占体积约为78% |
| Y | 含Y元素的物质焰色反应为黄色 |
| Z | 同周期元素中原子半径最小 |
| R | R元素原子的最外层电子数是K层电子数的3倍 |
(2)由X、Z两种元素组成的化合物甲,常温下为易挥发的淡黄色液体,甲分子构型为三角锥形,且分子里X、Z两种原子最外层均达到8个电子的稳定结构.甲遇水可形成一种常见的漂白性物质.则甲的结构式为
 ;
;(3)化合物乙(Y2R)溶液在空气中长期放置,与氧气反应会生成与过氧化钠的结构和化学性质相似的物质Y2R2,其溶液显黄色.则Y2R2的电子式为
 ,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.
,写出乙溶液在空气中变质生成Y2R2的化学方程式4Na2S+O2+2H2O═4NaOH+2Na2S2.Ⅱ.元素X与氢可形成多种化合物,如丙、丁、戊.
(4)丙为一元弱酸,酸性与醋酸类似,对热十分稳定但受撞击就爆炸.8.6 g 丙爆炸分生成H2和6.72L(标况下)X2,写出其爆炸的化学方程式2HN3=3N2+H2
(5)丁为离子化合物,遇水反应生成H2和气体戊,标况下戊的密度为0.76g•L-1则物质丁的化学式为H4H
Ⅲ.Z 的铁的化合物 FeZ3.在溶液中分三步水解:
Fe3++H2O?Fe(OH)2++H+K1
Fe(OH)2++H2O?Fe(OH)2++H+K2
Fe(OH)++H2O?Fe(OH)3+H+K3
以上水解反应的平衡常数 K1、K2、K3 由大到小的顺序是K1>K2>K3.
19.CoCl2•6H2O是一种饲料营养强化剂.一种利用水钴矿(主要成分为Co2O3、Co(OH)3,还含有少量Fe2O3、Al2O3、MnO等)制取CoCl2•6H2O的工艺流程如下:
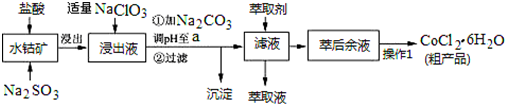
已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
③CoCl2•6H2O熔点为86℃,加热至110~120℃时,失去结晶水生成无水氯化钴.
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含的基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤、减压烘干.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B..
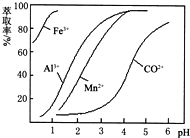
A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.

已知:①浸出液含有的阳离子主要有H+、Co2+、Fe2+、Mn2+、Al3+等,还原性Fe2+>Cl->Co2+;
②部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:(金属离子浓度为:0.01mol/L)
| 沉淀物 | Fe(OH)3 | Fe(OH)2 | Co(OH)2 | Al(OH)3 | Mn(OH)2 |
| 开始沉淀 | 2.7 | 7.6 | 7.6 | 4.0 | 7.7 |
| 完全沉淀 | 3.7 | 9.6 | 9.2 | 5.2 | 9.8 |
回答下列问题:
(1)写出浸出过程中Co2O3发生反应的离子方程式Co2O3+SO32-+4H+=2Co2++SO42-+2H2O.
(2)写出NaClO3发生反应的主要离子方程式ClO3-+6Fe2++6H+=Cl-+6Fe3++3H2O;若不慎向“浸出液”中加过量NaClO3时,可能会生成有毒气体,写出生成该有毒气体的离子方程式ClO3-+5Cl-+6H+=3Cl2↑+3H2O.
(3)“加Na2CO3调pH至a”,过滤所得到的沉淀成分为Fe(OH)3、Al(OH)3.
(4)“操作1”中包含的基本实验操作,它们依次是蒸发浓缩、冷却结晶和过滤、减压烘干.
(5)萃取剂对金属离子的萃取率与pH的关系如图.向“滤液”中加入萃取剂的目的是除去溶液中的Mn2+;其使用的最佳pH范围是B..

A.2.0~2.5 B.3.0~3.5
C.4.0~4.5 D.5.0~5.5.
6.未来清洁能源--纳米金属.如纳米铁可作为发动机的燃料,那时我们将迎来一个新的“铁器时代”.有一些专家也曾经指出,如果利用太阳能使燃烧产物如CO2、H2O、N2等重新组合的构想能够实现(如图),那么,不仅可以消除大气的污染,还可以节约燃料,缓解能源危机,在此构想的物质循环中太阳能最终转化为( )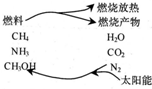

| A. | 化学能 | B. | 热能 | C. | 生物能 | D. | 电能 |
3.某羧酸酯的分子式为C57H104O6,1mol该酯完全水解可得到1mol甘油[HOCH2CH(OH)CH2OH]和3mol羧酸.该羧酸的分子式为( )
| A. | C18H34O2 | B. | C17H32O2 | C. | C18H36O2 | D. | C16H32O2 |
4.下列依据热化学方程式得出的结论正确的是( )
| A. | 氢气的燃烧热为285.8kJ/mol,则氢气燃烧的热化学方程式为2H2(g)+O2(g)═2H2O(g)△H=-571.6 kJ/mol | |
| B. | △H>0表示放热反应,△H<0表示吸热反应 | |
| C. | 因为焓变和熵变都与反应的自发性有关,因此焓变或熵变均可以单独作为反应自发性的判据 | |
| D. | 等质量的硫磺固体和硫蒸气分别完全燃烧,后者放出的热量多 |