��Ŀ����
7��̼��������FeCO3�������������Ҫ�ɷ֣���FeCO3���ȵ�200�濪ʼ�ֽ�ΪFeO��CO2�����ڿ����и�������FeCO3������Fe2O3���ݱ�����һ��������Fe2O3�ɱ����黹ԭΪ���������Ľ��������䷴ӦΪ��Fe2O3��s��+3CH4��g��?2Fe��s��+3CO��g��+6H2��g��-Q��1��ԭ������Ϊ26����Ԫ��λ��Ԫ�����ڱ��ĵ�������VIII�壮
��2����Ӧ��5L���ܱ������н��У�2min��ﵽƽ�⣬���Fe2O3�ڷ�Ӧ����������4.8g����ö�ʱ����H2��ƽ����Ӧ����Ϊ0.018mol•��L•min��-1
��3�����̶�������Fe2O3��s����CH4��g�����ں��º�ѹ�����У���һ�������·�Ӧ���ܱ����÷�Ӧ�ﵽƽ��״̬����BCD
A��CH4��ת���ʵ���CO�IJ��� B����������ƽ����Է�����������
C��v����CO����v����H2��=1��2 D�����������������
��4��FeO����CO���л�ԭ����֪��t��ʱ��FeO��s��+CO��g��?Fe��s��+CO2��g�� K=0.5
����1 L�ܱ������м���0.04 mol FeO��s������ͨ��x molCO��t��ʱ��Ӧ�ﵽƽ�⣮��ʱFeO��s����ת����Ϊ50%����x=0.06
��5��Fe2O3���������Ʊ�FeCl3��FeCl3��ˮ��Һ�е�ˮ���������
Fe3++H2O?Fe��OH��2++H+ K1
Fe��OH��2++H2O?Fe��OH��2++H+ K2
Fe��OH��2++H2O?Fe��OH��3 +H+ K3
����ˮ�ⷴӦ��ƽ�ⳣ��K1��K2��K3�ɴ�С��˳����K1��K2��K3
ͨ����������������ˮ�����ۺ����ɾۺ�������ӷ���ʽΪ��
xFe3++yH2O?Fex��OH����3x-y��+ y+yH+
��ʹƽ�������ƶ��ɲ��õķ�����ACD������ĸ ����
A����ˮϡ�� B����������NaCl����
C������ D����������Na2CO3����
���� ��1��FeԪ��λ�ڵ������ڵ�VIII�壻
��2��n��Fe2O3��=$\frac{4.8g}{160g/mol}$=0.03mol�����ݷ���ʽ֪����0.03mol�������μӷ�Ӧʱ��0.18mol�������ɣ�����v=$\frac{\frac{��n}{V}}{��t}$����ö�ʱ��������ƽ����Ӧ���ʣ�
��3�����淴Ӧ�ﵽƽ��״̬ʱ�������ʵ����ʵ��������ʵ���Ũ�ȡ��ٷֺ����Լ��ɴ������һϵ�����������䣻
��4���μӷ�Ӧ��n��FeO��=0.04mol��50%=0.02mol�����ݷ���ʽ֪���μӷ�Ӧ��n��CO��=n��CO2��=n��FeO��=0.02mol�����������Ϊ1L����ƽ��ʱc��CO��=$\frac{x-0.02}{1}$mol/L��c��CO2��=0.02mol/L��
��ѧƽ�ⳣ��K=$\frac{0.02}{x-0.02}$=0.5���ݴ˼���xֵ��
��5����Ԫ����ˮ��ʱ�����һ��ˮ��̶�ԶԶ���ڵڶ������ڶ���ˮ��̶�ԶԶ���ڵ�������
��ʹƽ�������ƶ������Բ��ü���������ӷ�Ӧ�����ʡ���ˮϡ�͡������¶ȵķ�����
��� �⣺��1��FeԪ��λ�ڵ������ڵ�VIII�壬�ʴ�Ϊ���ģ�VIII��
��2��n��Fe2O3��=$\frac{4.8g}{160g/mol}$=0.03mol�����ݷ���ʽ֪����0.03mol�������μӷ�Ӧʱ��0.18mol�������ɣ�v��H2��=$\frac{\frac{0.18mol}{5L}}{2min}$=$\frac{\frac{��n}{V}}{��t}$=0.018mol•��L•min��-1��
�ʴ�Ϊ��0.018mol•��L•min��-1��
��3��A��CH4��ת���ʵ���CO�IJ���ʱ���÷�Ӧ��һ���ﵽƽ��״̬���ʴ���
B����������ƽ����Է�����������ʱ�������ʵ����ʵ������䣬�÷�Ӧ�ﵽƽ��״̬������ȷ��
C��v����CO����v����H2��=1��2ʱ��ͬһ���ʵ����淴Ӧ������ȣ��÷�Ӧ�ﵽƽ��״̬������ȷ��
D�����������������ʱ���÷�Ӧ�ﵽƽ��״̬������ȷ��
��ѡBCD��
��4���μӷ�Ӧ��n��FeO��=0.04mol��50%=0.02mol�����ݷ���ʽ֪���μӷ�Ӧ��n��CO��=n��CO2��=n��FeO��=0.02mol�����������Ϊ1L����ƽ��ʱc��CO��=$\frac{x-0.02}{1}$mol/L��c��CO2��=0.02mol/L��
��ѧƽ�ⳣ��K=$\frac{0.02}{x-0.02}$=0.5��x=0.06��
�ʴ�Ϊ��0.06��
��5����Ԫ����ˮ��ʱ����Ϊÿһ��ˮ�ⶼ���������ӣ������ӵĴ�������ˮ�⣬�������һ��ˮ��̶�ԶԶ���ڵڶ������ڶ���ˮ��̶�ԶԶ���ڵ������������K1��K2��K3��
��ʹƽ�������ƶ������Բ��ü���������ӷ�Ӧ�����ʡ���ˮϡ�͡������¶ȵķ�������ѡACD��
�ʴ�Ϊ��K1��K2��K3��ACD��
���� ���⿼�黯ѧƽ����㡢����ˮ�⡢��ѧƽ��״̬�жϵ�֪ʶ�㣬Ϊ��Ƶ���㣬���ؿ���ѧ����������������ֻ�з�Ӧǰ��ı������������ʱ���淴Ӧ�ʹﵽƽ��״̬���ữѧƽ�ⳣ�����йؼ��㣬��Ŀ�ѶȲ���

 ÿ��10���ӿ�����������������ϵ�д�
ÿ��10���ӿ�����������������ϵ�д�| A�� | ���������ǿ�Ӧ | B�� | ��������Ư���� | ||
| C�� | ������ƿ���̼�ᷴӦ���ɴ����� | D�� | ���������ֽ� |
| A�� | ��ľ�Ҳ�����炙��ʹ��̬���� | B�� | ���ڳ�ʪ�Ļ��������� | ||
| C�� | �����Ȼ�����Һ��ɫ���� | D�� | Ũ������Һ�г�ζ |
| A�� | ����NaOH��Һ���Լ���Al2��SO4��3��MgCl2��Fe2��SO4��3������Һ | |
| B�� | ����ɫ��Ӧ���Լ����NaCl��K2SO4������ɫ��Һ | |
| C�� | ������������Һ���Լ���NH4Cl��NH4NO3�������� | |
| D�� | �ö����ЧӦ���Լ�����������������Ȼ�����Һ |
| ��� | ʵ����� | ʵ��Ŀ�� |
| A | A l��Mg�ֱ���ϡ����������Һ��Ӧ | �Ƚ�����þ�Ľ�����ǿ�� |
| B | 2mol/LNaOH��Һ�μӵ�1mol/LCaCl2��Һ�У�������ɫ���� | �Ƚ��ơ��ƵĽ�����ǿ�� |
| C | �������̼��Ʒ�Ӧ��ȡ��CO2ֱ��ͨ��Na2SiO3��Һ�У���Һ����� | �Ƚ�̼����ķǽ�����ǿ�� |
| D | Cl2��Br2�ֱ���H2��Ӧ | �Ƚ��ȡ���ķǽ�����ǿ�� |
| A�� | A | B�� | B | C�� | C | D�� | D |
| A�� | CuSO4��Һ | B�� | ʯ�� | C�� | ���� | D�� | ���� |
| ѡ�� | ���� | ��Һ | ���� | 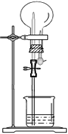 |
| A | NH3 | H2O����̪ | ��ɫ��Ȫ | |
| B | Cl2 | ����ʳ��ˮ | ��ɫ��Ȫ | |
| C | HCl | H2O��ʯ�� | ��ɫ��Ȫ | |
| D | SO2 | NaOH��Һ | ��ɫ��Ȫ |
| A�� | A | B�� | B | C�� | C | D�� | D |