题目内容
12.下列实验能达到实验目的是( )| 序号 | 实验操作 | 实验目的 |
| A | A l、Mg分别与稀氢氧化钠溶液反应 | 比较铝、镁的金属性强弱 |
| B | 2mol/LNaOH溶液滴加到1mol/LCaCl2溶液中,产生白色沉淀 | 比较钠、钙的金属性强弱 |
| C | 用盐酸和碳酸钙反应制取的CO2直接通入Na2SiO3溶液中,溶液变浑浊 | 比较碳、硅的非金属性强弱 |
| D | Cl2、Br2分别与H2反应 | 比较氯、溴的非金属性强弱 |
| A. | A | B. | B | C. | C | D. | D |
分析 A.不能用金属与碱反应比较金属性;
B.发生复分解反应生成氢氧化钙沉淀;
C.盐酸能与硅酸钠反应;
D.单质与氢气越易化合,则元素的非金属越强.
解答 解:A.不能用金属与碱反应比较金属性,无法比较金属性,故A错误;
B.发生复分解反应生成氢氧化钙沉淀,无法比较金属性,故B错误;
C.盐酸能与硅酸钠反应,应除掉后再通入硅酸钠溶液,故C错误;
D.单质与氢气越易化合,则元素的非金属越强,所以通过Cl2、Br2分别与H2反应,能比较氯与溴的非金属性强弱,故D正确.
故选D.
点评 本题考查物质的性质的比较的性质实验的设计与评价,为高考常见题型,侧重学生的分析能力和实验能力的考查,注意把握比较的角度,难度不大.

练习册系列答案
 举一反三期末百分冲刺卷系列答案
举一反三期末百分冲刺卷系列答案
相关题目
20.下列物质不能使酸性高锰酸钾溶液褪色的是( )
| A. | 甲苯 | B. | 苯 | C. | 乙烯 | D. | 乙炔 |
2.“各能级最多容纳的电子数,是该能级原子轨道数的二倍”,支撑这一结论的理论是( )
| A. | 构造原理 | B. | 泡利不相容原理 | C. | 洪特规则 | D. | 能量最低原理 |
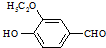 )是食品添加剂的增香原料,其香味比香草醛更加浓郁.
)是食品添加剂的增香原料,其香味比香草醛更加浓郁.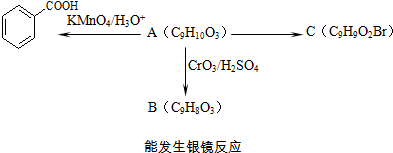
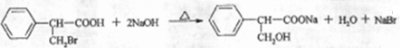
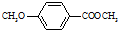 )是一种医药中间体.
)是一种医药中间体. )合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
)合成D.用反应流程图表示如下,请将后面一步的反应条件写在箭头下方,试剂或原料写在箭头上方,中间产物填在图中的方框内.
 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
 .
. 2NH3
2NH3