题目内容
19.25℃时,合成氨反应的热化学方程式为:N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol①在该温度时,取l mol N2和3mol H2放在密闭容器中,在催化剂存在下进行反应,测得反应放出的热量总是小于92.4kJ.(填“小于”,“大于”或“等于”)
②一定条件下,上述可逆反应在体积固定的密闭容器中进行,下列叙述能说明反应已达到平衡的是A.
A.NH3生成的速率与NH3分解的速率相等 B.混合气体的反应速率$\frac{2}{3}$v正(NH3)=v逆(H2)
C.容器内的密度不再变化 D.单位时间内消耗a mol N2,同时生成2a mol NH3.
分析 ①热化学方程式N2(g)+3H2(g)?2NH3(g);△H=-92.4kJ•mol-1的含义是:当1mol氮气和3mol氢气完全反应生成2mol氨气时,反应放热92.4KJ.
但该反应是可逆反应,取1molN2和3molH2放在一密闭容器中,不能完全反应生成2mol氨气,据此分析;
②根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①热化学方程式为N2(g)+3H2(g)?2NH3(g)△H=-92.4kJ/mol表示1mol氮气(g)与3mol氢气(g)生成2mol氨气(g)反应的热量为92.4kJ,由于该反应是可逆反应,加入1molN2和3molH2不可能完全反应,所以放出的热量总是小于92.4kJ,
故答案为:小于;
②A.NH3生成的速率与NH3分解的速率相等,正逆反应速率相等,达平衡状态,故正确;
B.化学平衡时混合气体的反应速应有:v正(NH3)=$\frac{2}{3}$v逆(H2),故错误;
C.容器内的密度一直不再变化随时间的变化而变化,故错误;
D.单位时间内消耗a mol N2,同时生成2a mol NH3,都体现的正反应方向,故错误;
故选A.
点评 本题考查了反应热计算、化学平衡状态的判断,应注意热化学方程式的含义和反应的可逆性,难度不大.

练习册系列答案
相关题目
11.根据表中有关短周期元素性质的数据,判断下列说法中不正确的是( )
| ① | ② | ③ | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |
| 原子半径 | 0.74 | 1.60 | 1.52 | 1.10 | 0.99 | 1.86 | 0.75 | 0.82 |
| 最高或 | +2 | +1 | +5 | +7 | +1 | +5 | +3 | |
| 最低化合价 | -2 | -3 | -1 | -3 |
| A. | ③和⑥、④和⑦分别处于同一主族 | |
| B. | 元素④处于第三周期ⅤA族 | |
| C. | 元素①与元素⑥形成的化合物中不可能存在共价键 | |
| D. | 元素⑧对应的氢氧化物可能具有两性 |
9.下列叙述中错误的是( )
| A. | H2在Cl2中燃烧、H2与Cl2的混合气体光照发生爆炸,都放出热量 | |
| B. | H2在O2中燃烧生成H2O放出能量,H2O分解为H2和O2吸收能量 | |
| C. | 氙和氟按一定比例混合,在一定条件下可直接发生反应:Xe+2F2═XeF4,该反应过程中Xe和F2都有化学键断裂 | |
| D. | 在CaO+H2O═Ca(OH)2的过程中CaO和H2O的总能量高于Ca(OH)2的总能量 |

 电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题:
电解原理在化学工业中有广泛应用.如图表示一个电解池,装有电解液a;X、Y是两块电极板,通过导线与直流电源相连.请回答以下问题: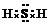 .
.