题目内容
 如图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3,则下列说法中不正确的是( )
如图为周期表中短周期的一部分,若A原子最外层电子数比次外层电子数少3,则下列说法中不正确的是( )| A、D的单质可跟B的氢化物的水溶液反应 |
| B、A、C可形成化合物AC5,分子中各原子均满足最外层8电子结构 |
| C、原子半径A>B>C |
| D、C的最高价氧化物对应水化物比B的最高价氧化物对应水化物的酸性强 |
考点:位置结构性质的相互关系应用
专题:元素周期律与元素周期表专题
分析:A原子最外层电子数比次外层电子数少3个,为短周期元素,则A应有3个电子层,最外层电子数为5,即A为P;
结合图中各元素的位置可知,B与D同主族,则B为S、C为Cl、D为O,然后结合元素及其单质、化合物的性质来解答.
结合图中各元素的位置可知,B与D同主族,则B为S、C为Cl、D为O,然后结合元素及其单质、化合物的性质来解答.
解答:
解:A原子最外层电子数比次外层电子数少3个,为短周期元素,则A应有3个电子层,最外层电子数为5,即A为P;结合图中位置可知,B与D同主族,则B为S,C为Cl、D为O,
A.D为O,其单质为氧气,B为S,其氢化物为磷化氢,硫化氢的水溶液能够与氧气反应生成硫单质和水,故A正确;
B.A为P、C为Cl,AC5为PCl5,氯原子最外层达到8电子稳定结构,而P原子最外层为5+5=10个电子,故B错误;
C.同周期从左向右原子半径逐渐减小,则原子半径的大小顺序为:A>B>C,故C正确;
D.B为S、C为Cl,Cl的非金属性大于S,则C的最高价氧化物对应水化物比B的最高价氧化物对应水化物的酸性强,故D正确;
故选B.
A.D为O,其单质为氧气,B为S,其氢化物为磷化氢,硫化氢的水溶液能够与氧气反应生成硫单质和水,故A正确;
B.A为P、C为Cl,AC5为PCl5,氯原子最外层达到8电子稳定结构,而P原子最外层为5+5=10个电子,故B错误;
C.同周期从左向右原子半径逐渐减小,则原子半径的大小顺序为:A>B>C,故C正确;
D.B为S、C为Cl,Cl的非金属性大于S,则C的最高价氧化物对应水化物比B的最高价氧化物对应水化物的酸性强,故D正确;
故选B.
点评:本题考查位置、结构、性质的关系,题目难度中等,元素A的推断是解答的突破口,注意利用短周期及位置图来分析元素即可解答,明确非金属性强弱的比较方法.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
对下列实验的描述正确的是( )
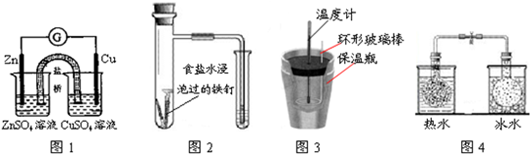

| A、图1所示的实验:根据检流计(G)中指针偏转的方向比较Zn、Cu的金属活泼性 |
| B、图2所示的实验:根据小试管中液面的变化判断铁钉发生析氢腐蚀 |
| C、图3所示的实验:根据温度计读数的变化用浓硫酸和NaOH反应测定中和热 |
| D、图4所示的实验:根据两烧瓶中气体颜色的变化(热水中变深、冰水中变浅)判断2NO2(g)?N2O4(g)是放热反应 |
下列叙述正确的是( )
| A、吸滤完毕或中途需停止吸滤时,应先关闭水龙头,然后拆下连接抽气泵和吸滤瓶的橡皮管 |
| B、在层析实验操作中,应沿试管壁小心地将展开剂慢慢倒入试管底部 |
| C、要从硝酸钾和食盐(少量)的混合物中,分离出较纯净的硝酸钾,应把它们制成热饱和溶液,降温后再过滤 |
| D、由于碘在酒精中的溶解度大,故可用酒精把碘水中的碘萃取出来 |
有甲、乙、丙、丁四种溶液:甲为氯化铝溶液、乙为硫化钠溶液、丙为氢氧化钠溶液、丁为硝酸溶液,若四种溶液的pH及溶液中水的电离程度分别两两相等,则下列判断正确的是( )
| A、pH:甲与乙相等;水的电离程度:丙与丁相等 |
| B、pH:甲与丙相等;水的电离程度:乙与丁相等 |
| C、pH:甲与丁相等;水的电离程度:乙与丙相等 |
| D、pH:甲与丁、乙与丙相等;电离程度:甲与乙、丙与丁相等 |
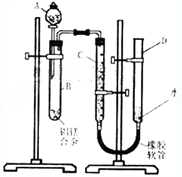 某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.
某学习小组用如图装置测定铝美合金中铝的质量分数和铝的相对原子质量.