题目内容
(1)某厂废水中含KCN,其浓度为650mg?L-1现用氯氧化法处理,发生如下反应(其中N均为-3价):KCN+2KOH+Cl2=KOCN+2KCl+H2O被氧化的元素是 .
(2)若将等浓度等体积的KCN与HCN混合,测得溶液中c(K+)>c(CN-),则该溶液的pH 7,要使c(K+)=c(CN-),应采取的措施是 ..
(3)若将10m3含KCN的浓度为650mg?L-1的废水中KCN氧化除去,需要标准状况下的氯气的体积为 L.
(4)已知:Fe2O3(s)+
C(s)=
CO2(g)+2Fe(s)△H=+234.1kJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
则2Fe(s)+
O2(g)=Fe2O3(s)的△H是 .
(2)若将等浓度等体积的KCN与HCN混合,测得溶液中c(K+)>c(CN-),则该溶液的pH
(3)若将10m3含KCN的浓度为650mg?L-1的废水中KCN氧化除去,需要标准状况下的氯气的体积为
(4)已知:Fe2O3(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
则2Fe(s)+
| 3 |
| 2 |
考点:热化学方程式,氧化还原反应,影响盐类水解程度的主要因素
专题:
分析:(1)化合价升高的元素被氧化;
(2)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,溶液中存在物料守恒和电荷守恒;
(3)根据KCN和氯气的反应比例计算,再根据V=Vm×n计算即可;
(4)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.
(2)混合溶液中c(HCN)>c(CN-)说明HCN的电离程度小于CN-的水解程度,溶液呈碱性,溶液中存在物料守恒和电荷守恒;
(3)根据KCN和氯气的反应比例计算,再根据V=Vm×n计算即可;
(4)根据盖斯定律由已知的热化学方程式乘以相应的数值进行加减,来构造目标热化学方程式,反应热也乘以相应的数值进行加减.
解答:
解:(1)反应中C元素化合价由KCN中+2价升高为KOCN中+4价,C元素被氧化,故答案为:碳(或C);
(2)将等浓度等体积的KCN与HCN混合,所得的混合溶液中含H+、OH-、K+和CN-四种离子,由于c(K+)>c(CN-),根据溶液的电荷守恒可知:c(OH-)>c(H+),溶液呈碱性,则pH>7,根据电荷守恒c(K+)+c(H+)=c(CN-)+c(OH-),若加HCN调pH=7,则c(K+)=c(CN-);
故答案为:大于;加HCN调pH=7即可使c(K+)=c(CN-);
(3)根据KCN+Cl2+2KOH═KOCN+2KCl+H20和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mg?L-1的废水中KCN物质的量=
=
=10mol,故氯气的物质的量为25mol,则标准状况下的氯气的体积V=25mol×22.4L/mol=5600L;
故答案为:5600;
(4)已知:Fe2O2(s)+
C(s)=
CO2(g)+2Fe(s)△H=234.1kJ?mol-1
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
由盖斯定律(2)×
-(1),得:2Fe(s)+
O2(g)=Fe2O3(s)△H=(-393.5kJ?mol-1)×
-234.1kJ?mol-1
即2Fe(s)+
O2(g)=Fe2O3(s)△H=-824.35kJ?mol-1,
故答案为:-824.4kJ?mol-1.
(2)将等浓度等体积的KCN与HCN混合,所得的混合溶液中含H+、OH-、K+和CN-四种离子,由于c(K+)>c(CN-),根据溶液的电荷守恒可知:c(OH-)>c(H+),溶液呈碱性,则pH>7,根据电荷守恒c(K+)+c(H+)=c(CN-)+c(OH-),若加HCN调pH=7,则c(K+)=c(CN-);
故答案为:大于;加HCN调pH=7即可使c(K+)=c(CN-);
(3)根据KCN+Cl2+2KOH═KOCN+2KCl+H20和2KOCN+4KOH+3Cl2═2CO2+N2+6KCl+2H2O知KCN和氯气的反应的物质的量之比为1:2.5,10m3含KCN的浓度为650mg?L-1的废水中KCN物质的量=
| m |
| M |
| 10×103L×650×10-3g/L |
| 65g/mol |
故答案为:5600;
(4)已知:Fe2O2(s)+
| 3 |
| 2 |
| 3 |
| 2 |
C(s)+O2(g)=CO2(g)△H=-393.5kJ?mol-1
由盖斯定律(2)×
| 3 |
| 2 |
| 3 |
| 2 |
| 3 |
| 2 |
即2Fe(s)+
| 3 |
| 2 |
故答案为:-824.4kJ?mol-1.
点评:本题考查了电解质溶液的酸碱性判断,电荷守恒、盖斯定律的应用,题目难度中等.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
有A、B、C、D四种非金属元素:A、B在反应中各结合1个电子,形成稳定的结构,且B-的还原性小于A-的还原性;氢化物稳定性HD<HA;原子序数C<D,且C、D的稳定结构的核外电子数相等.则这四种元素非金属金属由强到弱的排列顺序是( )
| A、A、B、C、D |
| B、B、A、C、D |
| C、A、B、D、C |
| D、B、A、D、C |
将过量的二氧化碳通入下列溶液中,最终会出现浑浊的是( )
| A、氯化钙溶液 | B、澄清的石灰水 |
| C、水玻璃 | D、硝酸钡溶液 |
下列用来表示物质变化的化学用语中,正确的是( )
| A、NH4NO3溶液呈酸性的原因:NH4++H2O=NH3?H2O+H+ |
| B、粗铜精炼时,与电源正极相连的是纯铜,电极反应式为:Cu-2e-=Cu2+ |
| C、硫酸氢钠溶液中滴加少量Ba(OH)2溶液的离子方程式:2H++SO42-+Ba2++2OH-=2H2O+BaSO4↓ |
D、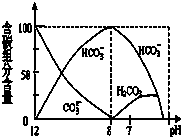 如图是在0.1 mol?L-1Na2CO3溶液中逐滴加入0.1 mol?L-1 HCl,则 pH=7时的离子方程式:H++HCO3-=CO2↑+H2O |
某一有机物A(C8H16O2)可发生如图变化;已知B为羧酸,且D氧化可以得到B,则A的可能结构有( )


| A、1种 | B、2种 | C、3种 | D、4种 |
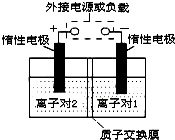 全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.
全钒液流储能电池,是利用不同价态离子对的氧化还原反应来实现化学能和电能相互转化的装置.现将钒的相关化合物溶解在pH=1的稀硫酸中,按下图组装一个模拟电池.