题目内容
4.下列装置所示的实验中,能达到实验目的是( )| A. |  分离碘和酒精 | B. |  除去Cl2中的HCl | C. |  排水法收集NO | D. |  配置硫酸溶液 |
分析 A.酒精和水混溶;
B.二者都与氢氧化钠溶液反应;
C.NO不溶于水,可用排水发生收集;
D.浓硫酸不能在容量瓶中稀释.
解答 解:A.酒精和水混溶,不能用分液的方法分离,应用蒸馏的方法,故A错误;
B.二者都与氢氧化钠溶液反应,应用饱和食盐水,故B错误;
C.NO不溶于水,可用排水发生收集,故C正确;
D.容量瓶只能在常温下使用,浓硫酸不能在容量瓶中稀释,故D错误.
故选C.
点评 本题考查较为综合,涉及物质的分离、提纯、溶液的配制备等知识,为高考常见题型,侧重于学生的分析、实验能力的考查,注意把握物质的性质以及实验的严密性和可行性的评价,难度不大.

练习册系列答案
相关题目
15.电化学降解法可用于治理水中硝酸盐的污染.电化学降解NO${\;}_{3}^{-}$的原理如图所示,下列说法不正确的是( )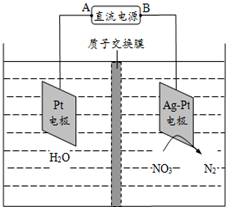

| A. | 铅蓄电池的A极为正极,电极材料为PbO2 | |
| B. | 该电解池的阴极反应式为:2NO3-+12H++10e-═N2↑+6H2O | |
| C. | 该电解池的总反应方程式为:2H2O+4NO3-$\frac{\underline{\;电解\;}}{\;}$2N2↑+5O2↑+4OH- | |
| D. | 若电解过程中转移2mol电子,则交换膜右侧电解液的质量减少5.6g |
12.在实验探究课上,同学们积极思考,涉及以下实验方案用以验证浓硫酸的吸水性,其中在理论上可行的方案有几种( )
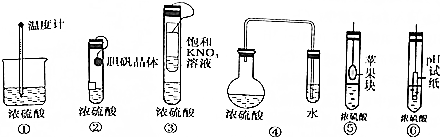

| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
9.三氟化氮(NF3)在潮湿的空气中能发生下列反应:3NF3+5H2O═2NO+HNO3+9HF.下列判断正确的是( )
| A. | 反应中NF3是氧化剂,H2O是还原剂 | |
| B. | 反应中被氧化与被还原的原子物质的量之比为2:1 | |
| C. | 若反应中生成0.2molHNO3,则反应共转移0.4mol电子 | |
| D. | NF3在潮湿空气中泄漏会产生红棕色气体 |
13.下列变化中,需加氧化剂才能实现的是( )
| A. | H2O→H2 | B. | FeCl3→FeCl2 | C. | C→CO2 | D. | CaO→Ca(OH)2 |
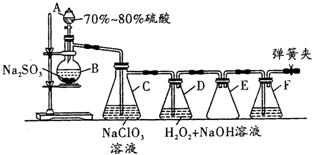 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.

 .
.