题目内容
4.实验室用足量MnO2与浓盐酸反应制取氯气,其装置如图1所示: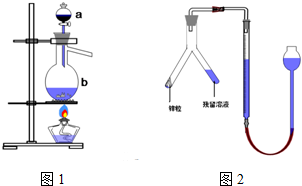
(1)图1中仪器a的名称是:分液漏斗;仪器b的名称是:蒸馏烧瓶;b中加入碎瓷片的作用是:防止暴沸;氯气通入水中可得氯水,其具有漂白性是因为含有HClO(填化学式)
(2)请写出仪器b中发生的反应的离子方程式:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑
(3)检查装置的气密性之后的操作依次是:A、C、B.(填序号)
A.向烧瓶中加入MnO2粉末 B.加热 C.向烧瓶中加入浓盐酸
(4)该反应会因为盐酸浓度下降而停止.为了测定反应残留液中盐酸的浓度,某探究小组提出下列实验方案:①甲同学的方案为:与足量AgNO3溶液反应,称量生成沉淀的质量.
②乙同学的方案为:与足量的锌反应,测量生成气体的体积,实验装置如图2所示(夹持装置已略去).使Y形管中的残留溶液与锌粒反应的正确操作是将锌粒转移至残留溶液中(“锌粒转移到残留溶液中”或“残留溶液转移到锌粒中”).在正确读取量气管读数时,视线要平视,要注意使漏斗液面与量气管中液面相平,除此外还须注意:恢复至室温.两种方案我认为乙(填甲或乙)同学的方案可行.
分析 (1)由仪器的结构可知,a为分液漏斗,b为蒸馏烧瓶;液体加热需要防止暴沸;氯水具有漂白性,是由于HClO的强氧化性;
(2)仪器b中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水;
(3)检验装置气密性后,向烧瓶中加入二氧化锰,再从分液漏斗中加入盐酸,最后加热制备氯气;
(4)若残留溶液转移到锌粒中,Y形管内壁会残留溶液,HCl不能与Zn完全反应;
读取体积时要满足压强回复到原压强,而且眼的视线要与液体的凹液面相切;
甲同学的方案:二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,实验不可行.
解答 解:(1)由仪器的结构可知,a为分液漏斗,b为蒸馏烧瓶;b中加入碎瓷片的作用是:防止暴沸;氯水具有漂白性,是由于HClO的强氧化性,
故答案为:分液漏斗;蒸馏烧瓶;防止暴沸;HClO;
(2)仪器b中二氧化锰与浓盐酸在加热条件下反应生成氯化锰、氯气与水,反应离子方程式为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑,
故答案为:MnO2+4H++2Cl-$\frac{\underline{\;\;△\;\;}}{\;}$Mn2++2H2O+Cl2↑;
(3)检验装置气密性后,向烧瓶中加入二氧化锰,再从分液漏斗中加入盐酸,最后加热制备氯气,
故答案为:A、C、D;
(4)若残留溶液转移到锌粒中,Y形管内壁会残留溶液,HCl不能与Zn完全反应,使测得的气体的量不准确,测得的盐酸的浓度不准,因此应将锌粒转移至残留溶液中,
压强对气体的体积有影响,该反应是在加热条件下进行的,温度升高气体压强增大,如果不回复到原温度,相当于将气体压缩了,使得测出的气体的体积减小,故温度要恢复到原温度时,同时上下移动右端的漏斗,使两端的液面的高度相同,视线要与液体的凹液面相切,读取测量气体的体积,
甲同学的方案中二氧化锰与浓盐酸反应生成氯化锰,也会与硝酸银反应,实验不可行,乙同学方案可能,
故答案为:将锌粒转移至残留溶液中;恢复至室温;乙.
点评 本题考查氯气的实验室制备、物质含量测定实验等,涉及化学仪器、对操作的分析评价、对实验原理的分析评价等,是化学实验综合考查,难度中等.

 阅读快车系列答案
阅读快车系列答案| A. | 两个非金属元素的原子 | B. | 同周期元素的原子 | ||
| C. | 同主族元素的原子 | D. | 活泼金属与活泼非金属的原子 |
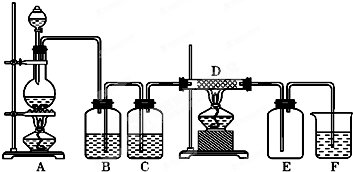 如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置.
如图所示,A是氯气的发生装置,B、C是净化气体的装置,D中装铁丝网;反应后E的底部有棕色固体聚集;F是吸收多余气体的装置. 如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.
如图所示的装置为铁的吸氧腐蚀实验.一段时间后,向插入铁钉的玻璃筒内滴入K3[Fe(CN)6]溶液,可观察到现象为铁钉附近的溶液有蓝色沉淀,该反应的离子方程式为Fe2++[Fe(CN)6]3-=Fe3[Fe(CN)6]2↓; 向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为O2+4e-+2H2O=4OH.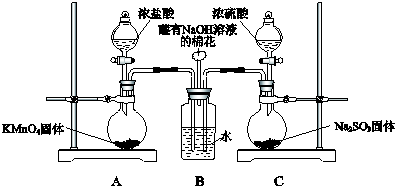
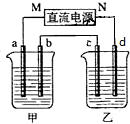 如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.
如图所示装置中,甲、乙两个烧杯分别盛放100g 5.00%的NaOH溶液、足量的CuSO4溶液,电极均为石墨电极.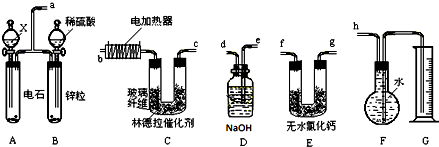
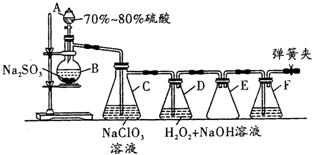 用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.
用二氧化氯(ClO2)可制备用途广泛的亚氯酸钠(NaClO2),实验室可用如图所示装置(部分支持装置省略)制备少量的亚氯酸钠.