题目内容
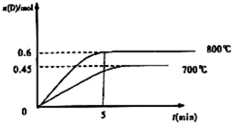 在容积为1L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
在容积为1L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:(1)能判断该反应达到化学平衡状态的依据是
A.容器中压强不变 B.混合气体中c(A)不变
C.2v正(B)=v逆(D) D.c(A)=c(C)
(2)若最初加入1.0molA和2.2molB,利用图中数据计算800℃时的平衡常数K=
(3)700℃时,某时刻测得体系中各物质的量如下:n(A)=1.1mol,n(B)=2.6mol,n(C)=0.9mol,n(D)=0.9mol,则此时该反应
考点:化学平衡状态的判断,化学平衡常数的含义,化学平衡的计算
专题:化学平衡专题
分析:(1)反应达到平衡状态时,正逆反应速率相等,平衡时各种物质的物质的量、浓度等不再发生变化,可由此进行判断;
(2)先计算平衡时各物质的浓度,再根据平衡常数公式计算化学平衡常数,升高温度,平衡向吸热反应方向移动,根据D物质的量的变化确定反应热;
(3)根据浓度商和化学平衡常数的相对大小判断,如果浓度商大于化学平衡常数,则反应向 正反应方向移动,如果浓度商小于化学平衡常数,则反应向逆反应方向移动.
(2)先计算平衡时各物质的浓度,再根据平衡常数公式计算化学平衡常数,升高温度,平衡向吸热反应方向移动,根据D物质的量的变化确定反应热;
(3)根据浓度商和化学平衡常数的相对大小判断,如果浓度商大于化学平衡常数,则反应向 正反应方向移动,如果浓度商小于化学平衡常数,则反应向逆反应方向移动.
解答:
解:(1)A.该反应是一个反应前后气体体积减小的可逆反应,当反应到达平衡状态时,容器中压强不变,所以能作为判断化学平衡的依据,故正确;
B.反应到达平衡状态时,混合气体中c(A)不变,故正确;
C.当v正(B)=2v逆(D)时,该反应达到平衡状态,故错误;
D.当c(A)=c(C)时,该反应不一定达到平衡状态,这样反应物浓度及转化率有关,故错误;
故选AB;
(2)反应达到平衡状态时,c(D)=0.6mol/L,c(C)=c(D)=0.6mol/L,c(A)=
mol/L=0.4mol/L,c(B)=
mol/L=1 mol/L,
K=
=
=0.9,升高温度,D的含量增大,说明平衡向正反应方向移动,则正反应是吸热反应,
故答案为:0.9;吸热;
(3)各物质的浓度分别为:c(A)=1.1mol/L,c(B)=2.6mol/L,c(C)=0.9mol/L,c(D)=0.9mol/L,
Q=
=0.109<0.9,则平衡向正反应方向移动,
故答案为:向正反应方向.
B.反应到达平衡状态时,混合气体中c(A)不变,故正确;
C.当v正(B)=2v逆(D)时,该反应达到平衡状态,故错误;
D.当c(A)=c(C)时,该反应不一定达到平衡状态,这样反应物浓度及转化率有关,故错误;
故选AB;
(2)反应达到平衡状态时,c(D)=0.6mol/L,c(C)=c(D)=0.6mol/L,c(A)=
| 1-0.6 |
| 1 |
| 2.2-0.6×2 |
| 1 |
K=
| c(C).c(D) |
| c(A).c2(B) |
| 0.6×0.6 |
| 0.4×12 |
故答案为:0.9;吸热;
(3)各物质的浓度分别为:c(A)=1.1mol/L,c(B)=2.6mol/L,c(C)=0.9mol/L,c(D)=0.9mol/L,
Q=
| 0.9×0.9 |
| 1.1×2.62 |
故答案为:向正反应方向.
点评:本题涉及化学反应速率的计算、化学平衡状态的判断、化学平衡常数的计算等知识点,注意分析化学方程式的特征以及温度对平衡移动的影响.

练习册系列答案
 星级口算天天练系列答案
星级口算天天练系列答案 芒果教辅达标测试卷系列答案
芒果教辅达标测试卷系列答案
相关题目
下列叙述正确的是( )
| A、在原电池的负极和电解池的阴极上都是发生失电子的氧化反应 |
| B、用惰性电极电解饱和NaCl溶液,若有1mol电子转移,则生成1mol NaOH |
| C、用惰性电极电解Na2SO4溶液,阴阳两极产物的物质的量之比为1:2 |
| D、镀层破损后,镀锡铁板比镀锌铁板更耐腐蚀 |
在N2(g)+3H2(g)?2NH3(g);△H<0.当分离出NH3后下列说法正确的是( )
| A、平衡向逆向移动 |
| B、平衡不移动 |
| C、正反应速率先变大后变小 |
| D、逆反应速率先变小后变大 |
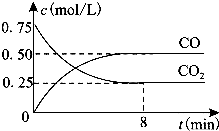 一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.
一定条件下铁可以和CO2发生反应:Fe(s)+CO2(g)=FeO(s)+CO(g)△H>0,1100℃时,向某密闭容器中加入足量铁粉并充入一定量的CO2气体,反应过程中CO2气体和CO气体的浓度与时间的关系如图所示.