题目内容
在N2(g)+3H2(g)?2NH3(g);△H<0.当分离出NH3后下列说法正确的是( )
| A、平衡向逆向移动 |
| B、平衡不移动 |
| C、正反应速率先变大后变小 |
| D、逆反应速率先变小后变大 |
考点:化学平衡的影响因素
专题:化学平衡专题
分析:分离出氨气减少生成物浓度,依据化学平衡移动原理分析判断,平衡正向进行.
解答:
解:A、当分离出NH3后,减少生成物浓度,平衡正向进行,故A错误;
B、当分离出NH3后,减少生成物浓度,平衡正向进行,故B错误;
C、减小生成物浓度瞬间正反应不变,逆反应速率减小,随反应进行正反应速率减小,逆反应速率增大,最后达到平衡,但新平衡状态反应速率小于原平衡反应速率,故C错误;
D、减小生成物浓度瞬间正反应不变,逆反应速率减小,随反应进行正反应速率减小,逆反应速率增大,最后达到平衡,但新平衡状态反应速率小于原平衡反应速率,故D正确;
故选D.
B、当分离出NH3后,减少生成物浓度,平衡正向进行,故B错误;
C、减小生成物浓度瞬间正反应不变,逆反应速率减小,随反应进行正反应速率减小,逆反应速率增大,最后达到平衡,但新平衡状态反应速率小于原平衡反应速率,故C错误;
D、减小生成物浓度瞬间正反应不变,逆反应速率减小,随反应进行正反应速率减小,逆反应速率增大,最后达到平衡,但新平衡状态反应速率小于原平衡反应速率,故D正确;
故选D.
点评:本题考查了平衡影响因素分析,平衡移动原理应用,掌握平衡移动原理分析方法是关键,题目较简单.

练习册系列答案
 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
下列有关实验原理或操作正确的是( )
A、 稀释浓硫酸 |
B、 闻气体气味 |
C、 称量30.46g的NaOH固体 |
D、 点燃酒精灯 |
已知W、X、Y、Z为短周期元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性比Z的气态氢化物的稳定性强,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )
| A、W与X形成的化合物中只含离子键 |
| B、Y、X、Z、W的原子半径依次减小 |
| C、W的气态氢化物的沸点一定高于Z的气态氢化物的沸点 |
| D、若W与Y的原子序数相差5,则二者形成化合物的化学式可能为Y3W2 |
2molCH4与足量的Cl2发生取代反应,反应完全后,得四种有机物物质的量相等,则消耗的Cl2的物质的量是( )
| A、2mol | B、2.5mol |
| C、4mol | D、5mol |
下列各组气体或溶液用括号内试剂加以鉴别,其中合理的是( )
| A、二氧化碳、一氧化碳、甲烷(新制的澄清石灰水) |
| B、氧气、氢气、氮气(炽热的氧化铜粉末) |
| C、氯化钠、硝酸银、碳酸钠(稀盐酸) |
| D、硫酸、硝酸钡、氯化钾(硫酸钠溶液) |
下列所述事实与化学(离子)方程式不相符的是( )
| A、能说明盐酸是强酸:2HCl+CaCO3=CaCl2+CO2↑+H2O |
| B、能说明NH3结合H+能力比H2O强:NH3+H3O+=NH4++H2O |
| C、能说明CH3COOH是弱电解质:CH3COO-+H2O?CH3COOH+OH- |
| D、铅蓄电池放电时正极发生如下反应,说明氧化性PbO2>Pb:PbO2+4H++SO42-+2e-=PbSO4+2H2O |
下列所得溶液的物质的量浓度等于0.1mol?L-1的是( )
| A、将0.1mol氨气充分溶解在1L水中 |
| B、将10g 1mol?L-1的硫酸与90g水混合 |
| C、将8g三氧化硫溶于水并配成1L溶液 |
| D、将16g CuSO4?5H2O溶于水并配成1L溶液 |
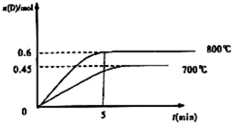 在容积为1L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题:
在容积为1L的密闭容器中,进行反应:A(g)+2B(g)?C(g)+D(g),在不同温度下,D的物质的量n(D)和时间t的关系如图.试回答下列问题: