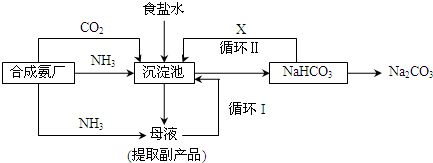
题目内容
某纯碱厂用了中国化学家侯德榜对国外纯碱生产改良的工艺,它的生产流程可简要表示如下,请回答:

(1)该生产工艺的名称是 .
(2)合成氨厂的主要设备名称为 .
(3)沉淀池中发生反应的化学方程式为 .
(4)工艺流程中设计循环1、循环2的目的是 .
(5)从粗盐水(含Ca2+、Mg2+、等杂质)到饱和食盐水需经过除杂工艺.加入除杂试剂的顺序为 (a.NaOH溶液,b、Na2CO3溶液,c.BaCl2溶液.填代号),除杂后.还需加入 以调节pH至中性.

(1)该生产工艺的名称是
(2)合成氨厂的主要设备名称为
(3)沉淀池中发生反应的化学方程式为
(4)工艺流程中设计循环1、循环2的目的是
(5)从粗盐水(含Ca2+、Mg2+、等杂质)到饱和食盐水需经过除杂工艺.加入除杂试剂的顺序为
考点:纯碱工业(侯氏制碱法)
专题:元素及其化合物
分析:(1)根据联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应过程是向氨化的饱和氯化钠溶液中通入二氧化碳气体没说错碳酸氢钠晶体和氯化铵溶液,过滤得到碳酸氢钠固体,加热分解得到纯碱;
(2)工业合成氨在合成塔中进行;
(3)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
(4)工艺流程中设计循环1提高NaCl原料的利用率,设计循环2提高CO2等原料的利用率;
(5)除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,加入试剂要注意氯化钡在碳酸钠的前面,以便把过量的氯化钡除掉;过滤后再加盐酸以调节pH至中性.
(2)工业合成氨在合成塔中进行;
(3)沉淀池中发生的化学反应为饱和食盐水中通入氨气和二氧化碳析出碳酸氢钠晶体,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
(4)工艺流程中设计循环1提高NaCl原料的利用率,设计循环2提高CO2等原料的利用率;
(5)除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,加入试剂要注意氯化钡在碳酸钠的前面,以便把过量的氯化钡除掉;过滤后再加盐酸以调节pH至中性.
解答:
解:(1)目前工业制碱方法有二:氨碱法和联合制碱法.题中方法由我们侯德榜所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,得到碳酸氢钠同时得到氯化铵,
故答案为:联合制碱法或侯德榜制碱法;
(2)工业合成氨在合成塔中进行,氮气和氢气在合成塔内发生化合反应生成氨气,故答案为:合成塔;
(3)从流程图可以看出,沉淀池中加入的反应物有氨气、二氧化碳、氯化钠,根据生成物是碳酸氢钠,可推出反应物有水,同时可知碳酸氢钠为沉淀,反应原理首先是氨气、二氧化碳和水反应生成碳酸氢氨,然后碳酸氢氨和氯化钠发生复分解反应交换成分生成碳酸氢钠晶体和氯化铵,所以反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
(4)整个生产流程中可进行循环使用的主要物质是NaCl、CO2,工艺流程中设计循环1、循环2节约了成本,减少了浪费,
故答案为:提高NaCl、CO2等原料的利用率,节约成本;
(5)除杂试剂为了除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸至不再有气体生成即可调节pH至中性,所以除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH),
故答案为:cba或cab或acb;盐酸.
故答案为:联合制碱法或侯德榜制碱法;
(2)工业合成氨在合成塔中进行,氮气和氢气在合成塔内发生化合反应生成氨气,故答案为:合成塔;
(3)从流程图可以看出,沉淀池中加入的反应物有氨气、二氧化碳、氯化钠,根据生成物是碳酸氢钠,可推出反应物有水,同时可知碳酸氢钠为沉淀,反应原理首先是氨气、二氧化碳和水反应生成碳酸氢氨,然后碳酸氢氨和氯化钠发生复分解反应交换成分生成碳酸氢钠晶体和氯化铵,所以反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
故答案为:NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;
(4)整个生产流程中可进行循环使用的主要物质是NaCl、CO2,工艺流程中设计循环1、循环2节约了成本,减少了浪费,
故答案为:提高NaCl、CO2等原料的利用率,节约成本;
(5)除杂试剂为了除去杂质离子,一般是过量的,碳酸钠可以将钙离子以及过量的钡离子沉淀下来,BaCl2、NaOH、Na2CO3加入的顺序必须满足最后加入碳酸钠,过滤后再加盐酸至不再有气体生成即可调节pH至中性,所以除杂试剂BaCl2、NaOH、Na2CO3加入的顺序还可以是NaOH、BaCl2、Na2CO3、(或BaCl2、Na2CO3、NaOH),
故答案为:cba或cab或acb;盐酸.
点评:本题主要考查了合成氨工业、制碱法的生产工艺流程,掌握生产的原理和步骤是解题的关键,要求学生具有分析和解决问题的能力,注意除去粗盐中含有的SO42-、Ca2+、Mg2+等杂质,加入的试剂顺序,题目难度中等.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
某溶液中只可能含有K+、NO3-、SO42-、NH4+、CO32-中的几种(不考虑少量的H+与OH-),取200mL该溶液分成两等份,进行如下实验:一份加入足量烧碱并加热,产生气体在标准状况下为224mL;另一份先加足量盐酸无现象,再加入足量BaCl2得到2.33g固体,则该溶液中( )
| A、可能含有K+ |
| B、肯定含有NO3-、SO42-、NH4+、CO32- |
| C、一定不含有NO3- |
| D、一定含有K+ |
对下列实验的评价,正确的是( )
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |
根据气体的性质,推测利用如图装置,下列气体可制得的是( )


| A、NO2 |
| B、Cl2 |
| C、O2 |
| D、NH3 |
氢氧化镁悬浊液存在下列平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),下列有关说法不正确的是( )
| A、加少量水,更多的氢氧化镁溶解 |
| B、加少量NaOH(s),氢氧化镁的溶解量减少 |
| C、加少量氯化氢,溶液的pH变大 |
| D、加少量MgCl2(s),溶液的pH变小 |
用NA表示阿伏加德罗常数,下列说法中正确的是( )
| A、2 L 0.1 mol?L-1 K2SO4溶液中离子所带电荷总数约为0.6 NA |
| B、标准状况下,22.4 L任意比的氢气和氯气的混合气体中含有的原子总数均为2NA |
| C、1 mol Cl2变为Cl-时得到的电子数为NA |
| D、由质量守恒定律可知1mol的氯化铁能形成NA个氢氧化铁胶体粒子 |