题目内容
氢氧化镁悬浊液存在下列平衡:Mg(OH)2(s)
Mg2+(aq)+2OH-(aq),下列有关说法不正确的是( )
| A、加少量水,更多的氢氧化镁溶解 |
| B、加少量NaOH(s),氢氧化镁的溶解量减少 |
| C、加少量氯化氢,溶液的pH变大 |
| D、加少量MgCl2(s),溶液的pH变小 |
考点:难溶电解质的溶解平衡及沉淀转化的本质
专题:电离平衡与溶液的pH专题
分析:在Mg(OH)2(s)
Mg2+(aq)+2OH-(aq)中,改变c(Mg2+)或c(OH-),可影响平衡移动,一般来说,加入NaOH或氯化镁,平衡逆向移动,加入盐酸等,可使平衡正向移动,以此解答该题.
解答:
解:A.加入少量水,c(Mg2+)、c(OH-)减小,平衡正向移动,促进氢氧化镁的溶解,故A正确;
B.加少量NaOH(s),c(OH-)增大,平衡逆向移动,氢氧化镁的溶解量减少,故B正确;
C.加少量氯化氢,发生中和反应,c(OH-)减小,则pH减小,故C错误;
D.加少量MgCl2(s),c(Mg2+)增大,平衡逆向移动,c(OH-)减小,则pH减小,故D正确.
故选C.
B.加少量NaOH(s),c(OH-)增大,平衡逆向移动,氢氧化镁的溶解量减少,故B正确;
C.加少量氯化氢,发生中和反应,c(OH-)减小,则pH减小,故C错误;
D.加少量MgCl2(s),c(Mg2+)增大,平衡逆向移动,c(OH-)减小,则pH减小,故D正确.
故选C.
点评:本题考查难溶电解质的溶解平衡,为高频考点,侧重于学生的分析能力的考查,题目难度一般,要注意从平衡移动的角度分析.

练习册系列答案
 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案
相关题目
一定质量的四种金属粉末,在足量的稀H2SO4中,生成标准状况下的氢气体积最大的是( )
| A、Na | B、Fe | C、Cu | D、Al |
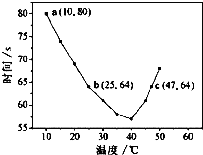 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B、温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| C、图中a点对应的NaHSO3平均反应速率为2.5×10-4mol?L-1?s-1 |
| D、图中b、c两点对应的NaHSO3反应速率:b<c |
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )| A、MgCO3、CaCO3、MnCO3 的Ksp依次减小 |
| B、a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32-) |
| C、b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-) |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
| A、当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 |
| B、电池的正极反应式为:O2+2H2O+4e-═4OH- |
| C、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D、燃料电池中c(KOH)不变 |
下列实验“操作和现象”与“结论”对应关系正确的是( )
| A、处理锅炉水垢中的CaSO4时,依次加入饱和Na2CO3溶液和盐酸,水垢溶解/Ksp:CaCO3<CaSO4 |
| B、用石墨作电极电解MgSO4溶液,某电极附近有白色沉淀生成/该电极为阳极 |
| C、向FeCl3和CuCl2混合溶液中加入铁粉,有红色固体析出/氧化性:Cu2+>Fe3+ |
| D、向某溶液中先滴加硝酸酸化,再滴加BaCl2溶液,有白色沉淀生成/该溶液中一定含有Ag+ |

 如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.
如图所示,U型管的左端被水和胶塞封闭有甲烷和氯气(体积比为1:4)的混和气体,假定氯气在水中溶解度可以忽略.将该装置放置在有光亮的地方,让混和气体缓慢地反应一段时间.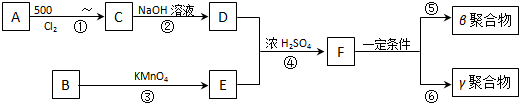
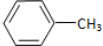
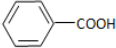
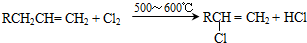
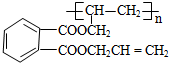 ,
,