题目内容
对下列实验的评价,正确的是( )
| A、加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,一定有SO42- |
| B、加入稀盐酸产生无色气体,将气体通入澄清石灰水中,溶液变浑浊,一定有CO32- |
| C、加入碳酸钠溶液产生白色沉淀,再加盐酸白色沉淀消失,一定有Ba2+ |
| D、验证烧碱溶液中是否含有Cl-,先加稍过量的稀硝酸除去OH-,再加入AgNO3溶液,如有白色沉淀,则证明有Cl- |
考点:常见阳离子的检验,常见阴离子的检验
专题:物质检验鉴别题
分析:A.加入氯化钡溶液生成的不溶于盐酸的白色沉淀可能为氯化银,原溶液中可能含有银离子;
B.该气体可能为二氧化碳、二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子等,不一定含有碳酸根离子;
C.能够与碳酸钠生成的溶于盐酸的白色沉淀不一定为碳酸钡,可能为碳酸钙,原溶液中可能含有钙离子;
D.根据AgCl不溶于硝酸的性质判断.
B.该气体可能为二氧化碳、二氧化硫,原溶液中可能含有碳酸氢根离子、亚硫酸根离子等,不一定含有碳酸根离子;
C.能够与碳酸钠生成的溶于盐酸的白色沉淀不一定为碳酸钡,可能为碳酸钙,原溶液中可能含有钙离子;
D.根据AgCl不溶于硝酸的性质判断.
解答:
解:A.氯化钡能与硫酸根离子或银离子结合生成不溶于水也不溶于酸的沉淀,加入氯化钡溶液有白色沉淀产生,再加盐酸,沉淀不消失,原溶液中可能含有银离子,不一定含有SO42-,故A错误;
B.将气体通入澄清石灰水中,溶液变浑浊,生成的气体可能为二氧化硫、二氧化碳,原溶液中可能存在HCO3-、SO32-等离子,不一定含有碳酸根离子,故B错误;
C.碳酸钡和碳酸钙等沉淀都可溶于盐酸,原溶液中可能含有Ca2+,不一定含有Ba2+,故C错误;
D.验证烧碱溶液中是否含Cl-,先加过量的稀硝酸除去OH-,AgCl不溶于硝酸,如有白色沉淀生成,证明含Cl-,故D正确.
故选D.
B.将气体通入澄清石灰水中,溶液变浑浊,生成的气体可能为二氧化硫、二氧化碳,原溶液中可能存在HCO3-、SO32-等离子,不一定含有碳酸根离子,故B错误;
C.碳酸钡和碳酸钙等沉淀都可溶于盐酸,原溶液中可能含有Ca2+,不一定含有Ba2+,故C错误;
D.验证烧碱溶液中是否含Cl-,先加过量的稀硝酸除去OH-,AgCl不溶于硝酸,如有白色沉淀生成,证明含Cl-,故D正确.
故选D.
点评:本题考查化学实验方案的评价,侧重于物质的检验和鉴别的考查,解答该类题目要注意排除离子的干扰的现象,注意实验的严密性,把握物质的性质,题目难度中等.

练习册系列答案
 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案 怎样学好牛津英语系列答案
怎样学好牛津英语系列答案
相关题目
设NA为阿伏加德罗常数的值.下列叙述正确的是( )
| A、1mol甲苯含有6NA个C-H键 |
| B、12 g石墨和C60的混合物中质子总数一定为6NA个 |
| C、25℃,pH=12的Na2CO3溶液中含有CO32-的数目为0.01NA |
| D、56g铁片投入足量浓硫酸中生成NA个SO2分子 |
一定质量的四种金属粉末,在足量的稀H2SO4中,生成标准状况下的氢气体积最大的是( )
| A、Na | B、Fe | C、Cu | D、Al |
常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:1混合后溶于水配成稀溶液,下列有关该混合溶液说法正确的是( )
| A、溶液中c(CO32-):c(HCO3-)<1:1 |
| B、溶液中c(OH-)+(CO32-)=c(H+)+c(HCO3-)+c(H2CO3) |
| C、向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 |
| D、将混合液蒸干,水解加剧,最终得NaOH固体 |
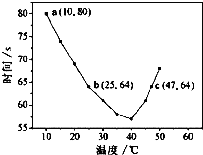 NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )
NaHSO3溶液在不同温度下均可被过量KIO3氧化,当NaHSO3完全消耗即有I2析出,根据I2析出所需时间可以求得NaHSO3的反应速率.将浓度均为0.020mol?L-1NaHSO3(含少量淀粉)10.0ml、KIO3(过量)酸性溶液40.0ml混合,记录10~55℃间溶液变蓝时间,55℃时未观察到溶液变蓝,实验结果如图.据图分析,下列判断不正确的是( )| A、40℃之前与40℃之后溶液变蓝的时间随温度的变化趋势相反 |
| B、温度高于40℃时,淀粉不宜用作该实验的指示剂 |
| C、图中a点对应的NaHSO3平均反应速率为2.5×10-4mol?L-1?s-1 |
| D、图中b、c两点对应的NaHSO3反应速率:b<c |
用电解质溶液为氢氧化钾水溶液的氢氧燃料电池电解饱和碳酸钠溶液一段时间,假设电解时温度不变,且用惰性电极,下列说法不正确的是( )
| A、当电池负极消耗m g气体时,电解池阴极同时有m g气体生成 |
| B、电池的正极反应式为:O2+2H2O+4e-═4OH- |
| C、电解后c(Na2CO3)不变,且溶液中有晶体析出 |
| D、燃料电池中c(KOH)不变 |
