题目内容
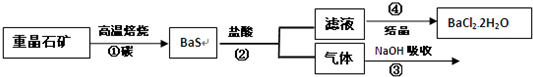
(1)硫酸是基本化工原料.某地硫铁矿资源丰富,水源充足,交通便利,风景秀丽,文物古迹较多,人口密集.如果在此地建造硫酸厂,有何利弊?
利是: ;弊是: .
(2)我国著名化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:(沉淀池中发生的化学反应为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓)
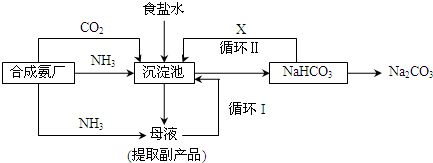
①上述生产纯碱的方法称 ,副产品氯化铵的一种用途为 .
②上述流程中X物质为 .
③侯德榜主要是设计了上述流程中的循环 (填“Ⅰ”或“Ⅱ”),使原料氯化钠的利用率从70%提高到90%以上.从沉淀池中取出沉淀的操作是 .
利是:
(2)我国著名化学家侯德榜改革国外的纯碱生产工艺,生产流程可简要表示如下:(沉淀池中发生的化学反应为:NH3+CO2+H2O+NaCl=NH4Cl+NaHCO3↓)

①上述生产纯碱的方法称
②上述流程中X物质为
③侯德榜主要是设计了上述流程中的循环
考点:纯碱工业(侯氏制碱法),工业制取硫酸
专题:
分析:(1)根据生产硫酸过程用到的原料以及硫酸生产中造成的环境方面的影响知识来回答;
(2)联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;主要的副产物为氯化铵,用途为化肥或电解液或焊药等;需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法;
(2)联合制碱法的原料为氨气、二氧化碳和饱和氯化钠,反应式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓;主要的副产物为氯化铵,用途为化肥或电解液或焊药等;需要考虑氯化铵的回收利用,要提高原料的利用率,可以用循环使用的方法;
解答:
解:(1)根据题干:某地硫铁矿资源丰富,水源充足,交通便利,这些条件为硫酸的生产提供了有利条件,但是,硫酸生产过程中,难免会产生污染性的气体二氧化硫,会对人以及环境造成污染,
故答案为:利:原料丰富,水源充足,交通便利;弊:可能破坏环境,损坏文物古迹,影响人们身体健康;
(2)①目前工业制碱方法有两种:氨碱法和联合制碱法,题中方法由我们侯德邦所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,得到一摩尔的碳酸氢钠同时得到一摩尔的氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,
故答案为:联合制碱法或侯德榜制碱法或侯氏制碱法;化肥或电解液或焊药等;
②在联合制碱法中NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
Na2CO3+H2O+CO2↑,二氧化碳是反应的原料同时也是反应的副产物,可以循环利用,
故答案为:CO2或二氧化碳;
③循环Ⅰ是将未反应的氯化钠返回沉淀池中,从固液混合物中分离出固体的方法为过滤,
故答案为:Ⅰ;过滤.
故答案为:利:原料丰富,水源充足,交通便利;弊:可能破坏环境,损坏文物古迹,影响人们身体健康;
(2)①目前工业制碱方法有两种:氨碱法和联合制碱法,题中方法由我们侯德邦所创,称为侯氏制碱法,也称为联合制碱法,反应方程式为NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,得到一摩尔的碳酸氢钠同时得到一摩尔的氯化铵,故副产物为氯化铵,氯化铵可用来制作化肥,
故答案为:联合制碱法或侯德榜制碱法或侯氏制碱法;化肥或电解液或焊药等;
②在联合制碱法中NH3+H2O+CO2+NaCl=NH4Cl+NaHCO3↓,2NaHCO3
| ||
故答案为:CO2或二氧化碳;
③循环Ⅰ是将未反应的氯化钠返回沉淀池中,从固液混合物中分离出固体的方法为过滤,
故答案为:Ⅰ;过滤.
点评:本题是一道化学和实际工业生产联系密切的考题,要求学生具有分析和解决问题的能力,注意掌握联合制碱法的原理,注意反应式以及副产物的回收利用、如何提高原料的利用率等,题目难度中等.

练习册系列答案
 名师点拨卷系列答案
名师点拨卷系列答案
相关题目
常温下,将Na2CO3和NaHCO3两种盐按物质的量比1:1混合后溶于水配成稀溶液,下列有关该混合溶液说法正确的是( )
| A、溶液中c(CO32-):c(HCO3-)<1:1 |
| B、溶液中c(OH-)+(CO32-)=c(H+)+c(HCO3-)+c(H2CO3) |
| C、向混合液中滴加少量稀盐酸或NaOH溶液,HCO3-的物质的量均会减少 |
| D、将混合液蒸干,水解加剧,最终得NaOH固体 |
 一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )
一定温度下,三种碳酸盐MCO3(M:Mg2+、Ca2+、Mn2+)的沉淀溶解平衡曲线如图所示.已知:pM=-lg c(M),pCO32-=-lg c(CO32-).下列说法不正确的是( )| A、MgCO3、CaCO3、MnCO3 的Ksp依次减小 |
| B、a 点可表示MnCO3 的饱和溶液,且c(Mn2+)=c(CO32-) |
| C、b 点可表示的CaCO3不饱和溶液,且c(Ca2+)<c(CO32-) |
| D、c 点可表示MgCO3 的不饱和溶液,且c(Mg2+)<c(CO32-) |