题目内容
19.为防止食盐结块,通常可在食盐中添加K4[Fe(CN)6](亚铁氰化钾)作为抗结剂.亚铁氰化钾易溶于水,在水溶液中会电离出K+和[Fe(CN)6]4-,在高于400℃时,K4[Fe(CN)6]会发生分解,产生剧毒的KCN、C、N2和灰白色固体化合物甲.将18g甲在足量氧气中灼烧,得到红棕色固体乙和2.24L(已折算成标准状况)CO2.请回答下列问题:
(1)甲的化学式Fe3C.
(2)亚铁氰化钾与稀硫酸共热会发生非氧化还原反应,并产生一种常见的含氧还原性有毒气体,写出该反应的离子方程式[Fe(CN)6]4-+12H++6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++6NH4++6CO↑.
(3)乙与某些气体混合物共热可制取甲,下列气体混合物不符合要求的是BC.
A.CO、CO2、H2 B.O2、CO2 C.CO2、H2O D. H2、CO
(4)甲也可由某单质与甲烷高温下生成,写出该反应的化学方程式3Fe+CH4$\frac{\underline{\;高温\;}}{\;}$Fe3C+2H2.
(5)在工业上可将含氰废水经蒸汽加热,使HCN气体逸出,用碳酸钾溶液在填充铁粉的塔内循环吸收,即生成亚铁氰化钾,同时还产生两种常见气体,写出该反应的化学方程式6HCN+2K2CO3+Fe=K4[Fe(CN)6]+2CO2+H2+2H2O.
(6)请设计实验方案检验食盐中是否添加了K4[Fe(CN)6]用铁粉、稀硫酸、双氧水制备硫酸铁溶液,将硫酸铁溶液滴入食盐水中,产生蓝色沉淀,证明含有K4Fe(CN)6,否则没有.
备选试剂:铁粉、稀硫酸、CuSO4溶液、双氧水.(已知:K4Fe(CN)6与Fe3+会产生蓝色沉淀)
分析 (1)K4[Fe(CN)6]会发生分解生成KCN、C、N2和灰白色固体化合物甲,甲在足量氧气中灼烧得到红棕色固体乙为Fe2O3,生成二氧化碳为0.1mol,则18g甲中含有碳原子为0.1mol,含有Fe的质量为18g-0.1mol×12g/mol=15.8g,Fe原子物质的量为$\frac{15.8g}{56g/mol}$=0.3mol,故甲的化学式为Fe3C;
(2)亚铁氰化钾与稀硫酸共热会发生非氧化还原反应,并产生一种常见的含氧还原性有毒气体,该气体为CO,还生成硫酸亚铁、硫酸钾、硫酸铵;
(3)乙应用还原性混合气体反应得到Fe3C;
(4)甲也可由某单质与甲烷高温下生成,应是Fe与甲烷反应生成Fe3C与氢气;
(5)HCN气体用碳酸钾溶液在填充铁粉的塔内循环吸收,生成亚铁氰化钾,同时还产生两种常见气体为氢气、二氧化碳;
(6)利用铁粉、稀硫酸、双氧水制备硫酸铁溶液,再利用K4Fe(CN)6与Fe3+产生蓝色沉淀进行检验.
解答 解:(1)K4[Fe(CN)6]会发生分解生成KCN、C、N2和灰白色固体化合物甲,甲在足量氧气中灼烧得到红棕色固体乙为Fe2O3,生成二氧化碳为0.1mol,则18g甲中含有碳原子为0.1mol,含有Fe的质量为18g-0.1mol×12g/mol=15.8g,Fe原子物质的量为$\frac{15.8g}{56g/mol}$=0.3mol,故甲的化学式为Fe3C,
故答案为:Fe3C;
(2)亚铁氰化钾与稀硫酸共热会发生非氧化还原反应,并产生一种常见的含氧还原性有毒气体,该气体为CO,还生成硫酸亚铁、硫酸钾、硫酸铵,反应离子方程式为:[Fe(CN)6]4-+12H++6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++6NH4++6CO↑,
故答案为:[Fe(CN)6]4-+12H++6H2O$\frac{\underline{\;\;△\;\;}}{\;}$Fe2++6NH4++6CO↑;
(3)乙应用还原性混合气体反应得到Fe3C,A、D选项中CO、氢气具有还原性,B、C选项中均不能可以,
故选:BC;
(4)甲也可由某单质与甲烷高温下生成,应是Fe与甲烷反应生成Fe3C与氢气,反应方程式为:3Fe+CH4$\frac{\underline{\;高温\;}}{\;}$Fe3C+2H2,
故答案为:3Fe+CH4$\frac{\underline{\;高温\;}}{\;}$Fe3C+2H2;
(5)HCN气体用碳酸钾溶液在填充铁粉的塔内循环吸收,生成亚铁氰化钾,同时还产生两种常见气体为氢气、二氧化碳,该反应的化学方程式为:6HCN+2K2CO3+Fe=K4[Fe(CN)6]+2CO2+H2+2H2O,
故答案为:6HCN+2K2CO3+Fe=K4[Fe(CN)6]+2CO2+H2+2H2O;
(6)用铁粉、稀硫酸、双氧水制备硫酸铁溶液,将硫酸铁溶液滴入食盐水中,产生蓝色沉淀,证明含有K4Fe(CN)6,否则没有,
故答案为:用铁粉、稀硫酸、双氧水制备硫酸铁溶液,将硫酸铁溶液滴入食盐水中,产生蓝色沉淀,证明含有K4Fe(CN)6,否则没有.
点评 本题考查无机物推断、陌生方程式的书写、实验方案设计等,是对学生综合能力的考查,难度较大.

 小学学习好帮手系列答案
小学学习好帮手系列答案 小学同步三练核心密卷系列答案
小学同步三练核心密卷系列答案| 化合物 | Fe(OH)2 | Fe(OH)3 | FePO4 | Fe3(PO4)2 |
| Ksp近似值 | 10-17 | 10-38 | 10-22 | 10-36 |
(2)为提供FePO4的产率,根据上述制备方法和表中数据,应采取的正确措施是d(填正确答案的标号).
a.不加H2O2 b.调节溶液pH至5 c.降低反应温度 d.增大NH4H2PO4的用量
(3)磷的含氧酸H3PO2与足量的NaOH溶液反应,生成NaH2PO2.则H3PO2为一元酸;在LiFePO4中的化学键有离子键、共价键,在制备LiFePO4的过程中加入H2C2O4的作用是还原FePO4.
(4)LiFePO4可作锂电池的电极材料.充电时,Li+从LiFePO4晶格中迁移出来,部分LiFePO4转化为Li1-xFePO4,则阳极的电极反应式为LiFePO4-xe-═Li1-xFePO4+xLi+.
(5)电化学还原TiO2是获取金属钛的常用方法.采用熔融盐作电解质,用石墨作阳极,总反应为TiO2$\frac{\underline{\;电解\;}}{\;}$Ti+O2↑
①电解过程中,阳极不断被消耗而需要定期更换,其原因是2O2--4e-═O2↑,C+O2=CO2(用反应式表示).
②电解由含80%FeTiO3的钛铁矿制取的TiO2得到12kg金属钛,已知电流效率为76%,则至少需要该种钛铁矿62.5kg.(电流效率=$\frac{实际产量}{理论产量}$×100%)
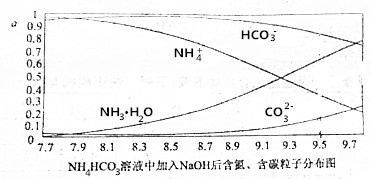
| A. | 开始阶段,HCO3-反而略有增加,可能是因为NH4HCO3溶液中存在H2CO3发生的主要反应是H2CO3+OH-═HCO3-+H2O | |
| B. | 当pH大于8.7以后,碳酸氢根离子和铵根离子同时与氢氧根离子反应 | |
| C. | pH=9.5时,溶液中c(HCO3-)>c(HN3•H2O)>c(NH4+)>c(CO32-) | |
| D. | 滴加氢氧化钠溶液时,首先发生的反应为2NH4HCO3+2NaOH═(NH4)2CO3+Na2CO3 |
| A. | 2014年德美科学家因开发超分辨率荧光显微镜获诺贝尔化学奖,使光学显微镜分辨率步入了纳米时代.利用此类光学显微镜可以观察活细胞内蛋白质等大分子 | |
| B. | 熟石膏与水混合成糊状后会很快凝固,转化为坚硬的生石膏,可用它制作石膏绷带 | |
| C. | 蚕丝、过氧化氢酶、核酸充分水解后均可得到α氨基酸 | |
| D. | 氢键在形成蛋白质二级结构和DNA双螺旋结构中起关键作用 |
| A. | 水 | B. | 四氯化碳 | C. | 盐酸 | D. | 硫酸镍溶液 |
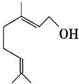 香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |

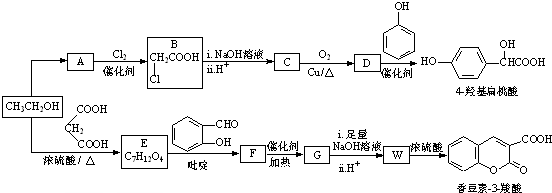
 ;②
;②
 )、羧基和醚键.(填名称)
)、羧基和醚键.(填名称) ;D→E的反应类型是氧化反应.
;D→E的反应类型是氧化反应. 等.
等. )的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下:
)的合成路线流程图(无机试剂可任选)).合成路线流程图示例如下: .
.
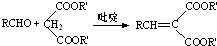 (R,R′,R″表示氢、烷基或芳基)
(R,R′,R″表示氢、烷基或芳基)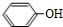 $\stackrel{催化剂}{→}$
$\stackrel{催化剂}{→}$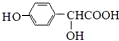 .
.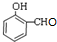 $\stackrel{吡啶}{→}$
$\stackrel{吡啶}{→}$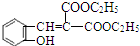 +H2O.
+H2O.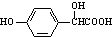 )的同分异构体
)的同分异构体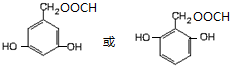 .
.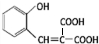 $\stackrel{浓硫酸}{→}$
$\stackrel{浓硫酸}{→}$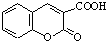 +H2O.
+H2O.