题目内容
9.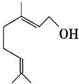 香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )
香叶醇是合成玫瑰香油的主要原料,结构可用键线式表示如图,键线式中每个端点和拐点处都代表有一个碳原子,氢原子可根据碳为四价的原则而相应地在碳上补充.下列有关香叶醇的叙述正确的是( )| A. | 香叶醇的分子式为C10H18O | B. | 不能使溴的四氯化碳溶液褪色 | ||
| C. | 不能使酸性高锰酸钾溶液褪色 | D. | 能发生加成反应不能发生取代反应 |
分析 该物质中含有碳碳双键和醇羟基,所以具有烯烃和醇的性质,能发生加成反应、加聚反应、还原反应、氧化反应、取代反应等,据此分析解答.
解答 解:A.由结构简式可知,该有机物的分子式为C10H18O,故A正确;
B.含有碳碳双键,所以能和溴发生加成反应而使溴的四氯化碳溶液褪色,故B错误;
C.含有碳碳双键,所以能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故C错误;
D.含有碳碳双键和醇羟基,所以能发生加成反应和取代反应,故D错误;
故选A.
点评 本题考查有机物结构和性质,为高频考点,把握官能团及其性质关系是解本题关键,侧重考查烯烃和醇的性质,理解官能团的性质即可,难度不大.

练习册系列答案
 天天练口算系列答案
天天练口算系列答案
相关题目
20.氨基甲酸铵(NH2COONH4)是一种白色固体,受热易分解.某小组模拟制备氨基甲酸铵,反应如下:2NH3(g)+CO2(g)?NH2COONH4(s)△H<0
(1)如用下图I装置制取氨气,锥形瓶中可选择的试剂是氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
干燥的NH3液体石蜡鼓泡瓶电动搅拌器ⅢCCl4尾气处理冰水液体石蜡鼓泡瓶干燥的CO2
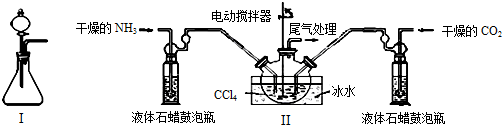
注:CCl4与液体石蜡均为惰性介质.
①图I中滴加液体的仪器名称是分液漏斗,液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率),发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称),为了得到干燥产品,应采取的方法是b(填写选项序号).
a.常压加热烘干b.减压40℃以下烘干c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸.
②根据①的结论:取氨基甲酸铵样品3.91g,用足量氢氧化钡溶液充分处理后,过滤、洗涤、干燥,测得沉淀质量为1.97g.则样品中氨基甲酸铵的质量分数为75.4%.[Mr(NH2COONH4)=78、Mr(NH4HCO3)=79、Mr((NH4)2CO3)=96、Mr(BaCO3)=197].
(1)如用下图I装置制取氨气,锥形瓶中可选择的试剂是氢氧化钠固体(或浓氨水与碱石灰或浓氨水与生石灰)等.
(2)制备氨基甲酸铵的装置如图Ⅱ所示,把NH3和CO2通入四氯化碳中,不断搅拌混合,生成的氨基甲酸铵的小晶体悬浮在CCl4中.当悬浮物较多时,停止制备.
干燥的NH3液体石蜡鼓泡瓶电动搅拌器ⅢCCl4尾气处理冰水液体石蜡鼓泡瓶干燥的CO2

注:CCl4与液体石蜡均为惰性介质.
①图I中滴加液体的仪器名称是分液漏斗,液体石蜡鼓泡瓶的作用是通过观察气泡,调节NH3与CO2通入比例(或通过观察气泡,控制NH3与CO2的反应速率),发生器用冰水冷却的原因是降低温度,提高反应物转化率(或降低温度,防止因反应放热造成产物分解).
②从反应后的混合物中分离出产品的实验方法是过滤(填写操作名称),为了得到干燥产品,应采取的方法是b(填写选项序号).
a.常压加热烘干b.减压40℃以下烘干c.高压加热烘干
(3)制得的氨基甲酸铵可能含有碳酸氢铵、碳酸铵中的一种或两种.
①设计方案,进行成分探究,请填写表中空格.限选试剂:蒸馏水、稀HNO3、BaCl2溶液、Ba(OH)2溶液、AgNO3溶液、稀盐酸.
| 实验步骤 | 预期现象和结论 |
| 步骤1:取少量固体样品于试管中,加入蒸馏水至固体溶解. | 得到无色溶液 |
| 步骤2:向试管中加入过量的BaCl2溶液,静置. | 溶液变浑浊,则证明固体中含有(NH4)2CO3. |
| 步骤3:取步骤2的上层清液于试管中加入少量的Ba(OH)2溶液. | 溶液不变浑浊,则证明固体中不含有NH4HCO3. |
17.设NA表示阿伏加德罗常数的值,下列说法中正确的是( )
| A. | 200 g 63%的浓硝酸中含氧原子个数为6NA | |
| B. | 50mL12mol•L-1盐酸与足量MnO2共热,转移的电子数为0.3NA | |
| C. | 氢氧燃料电池正极消耗22.4L(标准状况)气体时,电路中通过的电子数目为2NA | |
| D. | 若CH3COONa溶液中CH3COO-的数目为6NA,则Na+的数目大于6NA |
4.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 标准状况下,46 g乙醇中含有的共价键总数为8 NA | |
| B. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
14.某有机物分子式为C5H10O2,既能氢氧化钠溶液又能发生银镜反应的链状同分异构体有几种( )
| A. | 3种 | B. | 4种 | C. | 5种 | D. | 6种 |
1.下列说法正确的是( )
| A. | 电负性较大的元素在化合物中只能形成负价,不能形成正价 | |
| B. | 若元素X的第一电离能比元素Y的第一电离能小,则X的金属活动性不一定强于Y | |
| C. | H元素与F元素的电负性差值达1.9,所以HF属于离子化合物 | |
| D. | 某元素原子外围电子排布式为3d64s2,则此元素可能易显+2和+3价,且+3价稳定 |
15.工业上用惰性电极电解NO制备NH4NO3,其工作原理如图所示,下列说法正确的是( )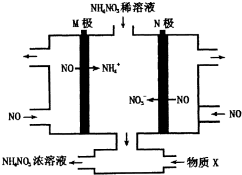

| A. | M极连接直流电源的正极 | |
| B. | 阳极上的电极反应为:NO-3e-+4OH-=NO3-+2H2O | |
| C. | 为使电解产物全部转化为NH4NO3浓溶液,需补充的物质X,则X为NH3 | |
| D. | 装置中加入稀NH4NO3溶液的目的是为了提高溶液的导电能力,可用NaNO3溶液代替 |

 .
.