题目内容
14.回答下列问题(1)写出肼(N2H4)的结构式
 .
.(2)在加热条件下,肼能和氧化铜反应,写出其化学反应方程式:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu+2H2O.
(3)氯化银能够溶解在稀的氨水中,写出该反应的离子反应方程式:AgCl+2NH3•H2O→[Ag(NH3)2]++Cl-+2H2O.
(4)配平下面的离子反应方程式:
2Fe3++1SO2+2H2O----2Fe2++1SO42-+4H+.
分析 (1)肼是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键;
(2)肼和氧化铜反应,铜化合价降低,氮化合价升高,根据原子守恒配平;
(3)AgCl溶于氨水发生络合反应,生成二铵合银离子;
(4)氧化还原反应中,元素化合价升高值等于元素化合价降低值,根据电子守恒、原子守恒来配平方程式.
解答 解:(1)联氨是共价化合物氮原子和氢原子形成共价键,氮原子和氮原子间也形成共价键,结构式为: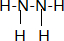 ,
,
故答案为: ;
;
(2)肼和氧化铜反应,铜化合价降低(+2→0),N2H4氮化合价升高(-2→0),最小公倍数为4,所以氧化铜前系数为2,所以方程式为:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu+2H2O,
故答案为:N2H4+2CuO$\frac{\underline{\;\;△\;\;}}{\;}$N2↑+2Cu+2H2O;
(3)AgCl溶于氨水发生络合反应,生成氯化二氨合银,外界离子为氯离子,所以离子反应为:AgCl+2NH3•H2O→[Ag(NH3)2]++Cl-+2H2O,
故答案为:AgCl+2NH3•H2O→[Ag(NH3)2]++Cl-+2H2O;
(4)铁离子和二氧化硫反应,铁化合价变化(+3→+2),硫化合价(+4→+6),所以最小公倍数为2,所以铁离子前系数为2,二氧化硫前系数为1,所以根据电子守恒、原子守恒配平为:SO2+2Fe3++2H2O=2Fe2++SO42-+4H+,
故答案为:2、1、2H2O、2、1、4H+.
点评 本题考查常用的化学用语书写,侧重氧化还原反应的考查,掌握相关反应的原理是解答关键,题目难度中等.

练习册系列答案
 提分百分百检测卷系列答案
提分百分百检测卷系列答案
相关题目
7.下列离子方程式书写正确的是( )
| A. | 将H2O2滴入酸性KMnO4溶液中:2MnO4-+10H++3H2O2=2Mn2++3O2↑+8H2O | |
| B. | 碳酸氢铵溶液和足量氢氧化钠溶液混合并加热:NH4++OH-$\frac{\underline{\;加热\;}}{\;}$NH3↑+H2O | |
| C. | 用惰性电极电解氯化钠溶液:2 H++2Cl-$\frac{\underline{\;通电\;}}{\;}$H2↑+Cl2↑ | |
| D. | 1mol•L-1的NaAlO2溶液和2.5 mol•L-1的盐酸等体积混合:2 AlO2-+5 H+=Al(OH)3↓+Al3++H2O |
5.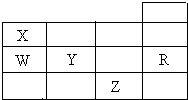 如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )
如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )
 如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )
如表为元素周期表前四周期的一部分,X、W、Y、R、Z分别代表元素符号,其中R元素的原子每个电子层都达到稳定结构.下列叙述中正确的是( )| A. | XZ3是平面正三角形分子 | |
| B. | 钠与X形成的化合物Na3X和NaX3都是含有共价键的离子晶体 | |
| C. | W与Y元素的最高价氧化物对应的水化物酸性前者弱于后者 | |
| D. | X的氢化物比W的氢化物稳定,但沸点前者比后者低 |
9.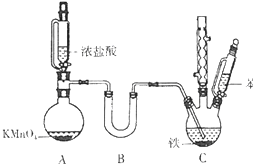 氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):
氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):
可能用到的有关数据如下: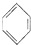 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$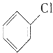 +HCl
+HCl
在装置A中利用浓盐酸和KMnO4反应缓慢制备氯气,把氯气干燥后通入装有39mL苯的反应器C中(内有铁屑作催化剂),维持反应温度在40~60℃,回流40分钟.温度过高会产生过多的邻二氯苯和对二氯苯.反应结束后,冷却至室温.将C中的液体倒入分液漏斗中,分别用NaOH溶液和蒸馏水洗涤,分离出的产物干燥后,进行蒸馏纯化,得到22g纯净的氯苯.
回答下列问题:
(1)A装置中制备氯气的离子方程式为2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O.
(2)B装置中盛放的药品为CaCl2或P2O5,C装置中采用的加热方法最好为40℃-60℃的水浴加热.
(3)已知浓盐酸和苯都具有较强的挥发性.采用如图所示装置加入液体的优点是防止液体挥发,能够平衡压强,使液体顺利流下.
(4)用氢氧化钠溶液洗涤可以除去杂质的化学式为HCl、Cl2、FeCl3,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净.
(5)该实验存在一定缺陷,改进措施为将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气.
(6)该实验所得氯苯的产率为44.4%(保留小数点后一位).
 氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):
氯苯是重要的有机化工原料.实验室制备氯苯的反应原理、实验装置如图所示(加热装置已略去):可能用到的有关数据如下:
 +Cl2$\stackrel{FeCl_{3}}{→}$
+Cl2$\stackrel{FeCl_{3}}{→}$ +HCl
+HCl| 沸点(℃) | 密度(g•mL-1) | 溶解性 | |
| 苯 | 80.1 | 0.88 | 难溶于水 |
| 氯苯 | 132.2 | 1.10 | 难溶于水,易溶于有机溶剂 |
| 对二氯苯 | 173.4 | 1.46 | 难溶于水,易溶于有机溶剂 |
| 邻二氯苯 | 180.4 | 1.30 | 难溶于水,易溶于有机溶剂 |
回答下列问题:
(1)A装置中制备氯气的离子方程式为2MnO4-+16H++10Cl-=2Mn2+↑+5C12↑+8H2O.
(2)B装置中盛放的药品为CaCl2或P2O5,C装置中采用的加热方法最好为40℃-60℃的水浴加热.
(3)已知浓盐酸和苯都具有较强的挥发性.采用如图所示装置加入液体的优点是防止液体挥发,能够平衡压强,使液体顺利流下.
(4)用氢氧化钠溶液洗涤可以除去杂质的化学式为HCl、Cl2、FeCl3,检验产品洗涤干净的方法为取最后一次洗涤液于试管中,加入硝酸银,若不出现沉淀,则证明已经洗干净.
(5)该实验存在一定缺陷,改进措施为将冷凝管上端逸出的HCl、Cl2通入NaOH溶液中,防止污染空气.
(6)该实验所得氯苯的产率为44.4%(保留小数点后一位).
3.某小组同学用如图所示装置研究电化学原理.下列关于该原电池的说法不正确的是( )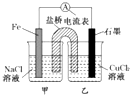

| A. | 原电池的总反应为 Fe+Cu2+=Fe2++Cu | |
| B. | 反应前,电极质量相等,一段时间后,两电极质量相差12g,导线中通过0.2 mol电子 | |
| C. | 其他条件不变,若将CuCl2溶液换为NH4Cl溶液,石墨电极反应式为2H++2e-=H2↑ | |
| D. | 盐桥中是KNO3溶液,则盐桥中NO3-移向乙烧杯 |
4.设NA为阿伏加德罗常数的数值,下列说法错误的是( )
| A. | 标准状况下,46 g乙醇中含有的共价键总数为8 NA | |
| B. | 在含Al3+总数为NA的AlCl3溶液中,Cl-总数为3NA | |
| C. | 常温常压下,7.8 gNa2S和Na2O2的混合物中,阴离子所含电子数为1.8 NA | |
| D. | 一定条件下,2molSO2和1molO2混合在密闭容器中充分反应后容器中的分子数大于2NA |
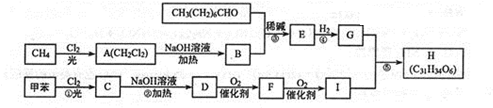
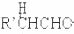 $\stackrel{稀碱}{→}$
$\stackrel{稀碱}{→}$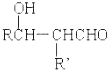
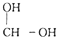 -OH$\stackrel{-H_{2}O}{→}$RCHO
-OH$\stackrel{-H_{2}O}{→}$RCHO .
. .
.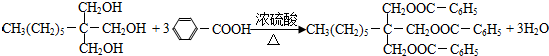 .
. +CO$→_{△}^{AlCl_{3},HCl}$
+CO$→_{△}^{AlCl_{3},HCl}$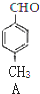 $→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$
$→_{OH-,△}^{CH_{3}CHO}$B$→_{②H+}^{①C}$ $→_{浓硫酸△}^{CH_{3}OH}$E
$→_{浓硫酸△}^{CH_{3}OH}$E .
.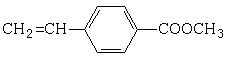 B.
B.
 D
D
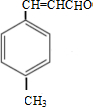
 .
.