题目内容
下表为周期表的一部分,表中所列的字母分别代表一种化学元素.
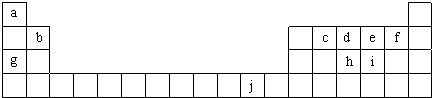
用化学用语回答下列问题:
(1)写出元素j的基态原子核外电子排布式 .
(2)da3分子的VSEPR模型是 .
(3)ci2与ce2比较,沸点较高的是 (写分子式).
(4)第一电离能:h i;
(5)电负性:g b(填“>”、“<”或“=”).
(6)d元素的单质的等电子体的粒子符号为 (任写一种)
(7)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子中心离子配位数为 .写出蓝色沉淀溶解在氨水中的离子方程式 .

用化学用语回答下列问题:
(1)写出元素j的基态原子核外电子排布式
(2)da3分子的VSEPR模型是
(3)ci2与ce2比较,沸点较高的是
(4)第一电离能:h
(5)电负性:g
(6)d元素的单质的等电子体的粒子符号为
(7)将氨水滴入到j的硫酸盐溶液中,先产生蓝色沉淀,然后沉淀逐渐溶解并得到深蓝色溶液,显深蓝色的离子中心离子配位数为
考点:元素周期律和元素周期表的综合应用
专题:元素周期律与元素周期表专题
分析:由元素在周期表中位置,可知a为H、b为Be、c为C、d为N、e为O、f为F、g为Na、h为P、i为S、j为Cu.
(1)根据能量最低原理书写Cu基态原子核外电子排布式;
(2)计算NH3分子中N原子价层电子对数,确定其VSEPR模型;
(3)根据常温下物质的状态判断沸点高低;
(4)同周期自左而右第一电离能呈增大趋势,当元素原子各轨道处于半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素;
(5)金属性越弱,电负性越大;
(6)原子总数相等,价电子总数相等的微粒互为等电子体;
(7)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到四氨合铜络离子,溶液呈深蓝色.
(1)根据能量最低原理书写Cu基态原子核外电子排布式;
(2)计算NH3分子中N原子价层电子对数,确定其VSEPR模型;
(3)根据常温下物质的状态判断沸点高低;
(4)同周期自左而右第一电离能呈增大趋势,当元素原子各轨道处于半满、全满、全空时,能量较低,第一电离能高于同周期相邻元素;
(5)金属性越弱,电负性越大;
(6)原子总数相等,价电子总数相等的微粒互为等电子体;
(7)将氨水滴入到硫酸铜溶液中,先产生氢氧化铜蓝色沉淀,然后沉淀逐渐溶解并得到四氨合铜络离子,溶液呈深蓝色.
解答:
解:由元素在周期表中位置,可知a为H、b为Be、c为C、d为N、e为O、f为F、g为Na、h为P、i为S、j为Cu.
(1)Cu原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)NH3分子中N原子价层电子对数=3+
=4,其VSEPR模型为正四面体,
故答案为:正四面体;
(3)常温下,CS2为液态体,CO2为气态,故沸点CS2>CO2,
故答案为:CS2;
(4)P元素的3p轨道为半满稳定状态,能量降低,故第一电离能P>S,故答案为:>;
(5)金属性Na>Be,金属性越强,电负性越小,故电负性Na<Be,故答案为:<;
(6)d元素的单质为N2,其等电子体的粒子为 CO等,故答案为:CO;
(7)氢氧化铜与溶于氨水形成[Cu(NH3)4]2+,离子中心离子配位数为4,氢氧化铜溶解在氨水中的离子方程式为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:4;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O.
(1)Cu原子核外电子数为29,基态原子核外电子排布式为:1s22s22p63s23p63d104s1,
故答案为:1s22s22p63s23p63d104s1;
(2)NH3分子中N原子价层电子对数=3+
| 5-1×3 |
| 2 |
故答案为:正四面体;
(3)常温下,CS2为液态体,CO2为气态,故沸点CS2>CO2,
故答案为:CS2;
(4)P元素的3p轨道为半满稳定状态,能量降低,故第一电离能P>S,故答案为:>;
(5)金属性Na>Be,金属性越强,电负性越小,故电负性Na<Be,故答案为:<;
(6)d元素的单质为N2,其等电子体的粒子为 CO等,故答案为:CO;
(7)氢氧化铜与溶于氨水形成[Cu(NH3)4]2+,离子中心离子配位数为4,氢氧化铜溶解在氨水中的离子方程式为:Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O,
故答案为:4;Cu(OH)2+4NH3?H2O=[Cu(NH3)4]2++2OH-+4H2O.
点评:本题是对物质结构的考查,涉及核外电子排布、价层电子对互斥理论、分子结构与性质、电离能、电负性、元素周期表、等电子体,配合物等,注重常考知识点的考查,需要学生具备扎实的基础,注意同周期越大第一电离能异常原因,难度中等.

练习册系列答案
 轻巧夺冠周测月考直通名校系列答案
轻巧夺冠周测月考直通名校系列答案
相关题目