题目内容
含1.204×1024个Cl-的BaCl2溶液100mL中,求BaCl2的物质的量是多少?溶液中Ba2+的物质的量浓度是多少?
考点:物质的量浓度的相关计算
专题:计算题
分析:根据n=
计算出1.204×1024个Cl-的物质的量,然后根据氯化钡的化学式组成、氯离子的物质的量计算出氯化钡、钡离子的物质的量,再根据c=
计算出钡离子的物质的量浓度.
| N |
| NA |
| n |
| V |
解答:
解:1.204×1024个Cl-的物质的量为:n(Cl-)=
=2mol,
钡离子的物质的量为:n(Ba2+)=
×n(Cl-)=
×2mol=1mol,
溶质氯化钡的物质的量为:n(BaCl2)=n(Ba2+)=1mol,
溶液中钡离子的浓度为:c(Ba2+)=
=10mol/L,
答:BaCl2的物质的量是1mol,溶液中Ba2+的物质的量浓度是10mol/L.
| 1.204×1024 |
| 6.02×1023/mol |
钡离子的物质的量为:n(Ba2+)=
| 1 |
| 2 |
| 1 |
| 2 |
溶质氯化钡的物质的量为:n(BaCl2)=n(Ba2+)=1mol,
溶液中钡离子的浓度为:c(Ba2+)=
| 1mol |
| 0.1L |
答:BaCl2的物质的量是1mol,溶液中Ba2+的物质的量浓度是10mol/L.
点评:本题考查了物质的量浓度的计算,题目难度不大,试题侧重基础知识的考查,注意掌握物质的量与阿伏伽德罗常数、物质的量浓度的关系,明确物质的量浓度的概念及计算方法.

练习册系列答案
 口算题卡加应用题集训系列答案
口算题卡加应用题集训系列答案 综合自测系列答案
综合自测系列答案
相关题目
以氯乙烷为原料制取乙二酸(HOOC-COOH)过程中,要依次经过下列步骤中的( )
①与NaOH的水溶液共热
②与NaOH的醇溶液共热
③与浓硫酸共热到170℃
④在一定条件下与氯气加成
⑤在催化剂存在的情况下与氧气共热.
①与NaOH的水溶液共热
②与NaOH的醇溶液共热
③与浓硫酸共热到170℃
④在一定条件下与氯气加成
⑤在催化剂存在的情况下与氧气共热.
| A、①③④①⑤ | B、②④①⑤ |
| C、①③④② | D、③④①⑤ |
标准状况下,500L的HCl气体溶于水形成1L的盐酸溶液,则该盐酸的物质的量浓度为( )
A、
| ||
| B、500 mol/L | ||
| C、5 mol/L | ||
| D、无法计算 |
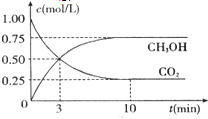 为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质.如工业上已实现CO2和H2反应生成甲醇的转化.已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0
为减弱温室效应,除了减少CO2的排放、植树造林、将液态CO2注入深海等措施外,还有一种思路是将CO2转化成其它可燃物质.如工业上已实现CO2和H2反应生成甲醇的转化.已知:在一恒温、恒容密闭容器中充入l mol CO2和3mol H2,一定条件下发生反应:CO2(g)+3H2(g)=CH3OH(g)+H2O(g)△H=-49.0