题目内容
(1)用单线桥表示下列反应中电子转移的方向和数目,并填空
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
反应中若有71克Cl2生成,转移的电子数为 个.
(2)请用“双线桥”法分析下列氧化还原反应中电子转移的方向和数目,并填空
2K2S+K2SO3+3H2SO4═3K2SO4+3S↓+3H2O
氧化产物与还原产物的物质的量之比为 .
(3)已知离子反应:RO
+6I-+6H+═R-+3I2+3H2O,试根据离子方程式必须“质量守恒,电荷守恒,得失电子守恒”等判断:n= ,R元素在RO
中的化合价是 .
2KMnO4+16HCl(浓)=2KCl+2MnCl2+5Cl2↑+8H2O
反应中若有71克Cl2生成,转移的电子数为
(2)请用“双线桥”法分析下列氧化还原反应中电子转移的方向和数目,并填空
2K2S+K2SO3+3H2SO4═3K2SO4+3S↓+3H2O
氧化产物与还原产物的物质的量之比为
(3)已知离子反应:RO
n- 3 |
n- 3 |
考点:氧化还原反应的电子转移数目计算,氧化还原反应的计算
专题:氧化还原反应专题
分析:(1)氧化还原反应中转移的电子数目=化合价升高的数目=化合价降低的数目;
(2)还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物;
(3)根据电子守恒和化合价规则来计算.
(2)还原剂对应的产物是氧化产物,氧化剂对应的产物是还原产物;
(3)根据电子守恒和化合价规则来计算.
解答:
解:(1)用单线桥表示反应中电子转移的方向和数目为 ,当生成5mol×71g/mol=355g的氯气时,转移的电子为10mol,当生成71克(1mol)Cl2生成,转移的电子为2mol,即2NA个,故答案为:
,当生成5mol×71g/mol=355g的氯气时,转移的电子为10mol,当生成71克(1mol)Cl2生成,转移的电子为2mol,即2NA个,故答案为: ;2NA;
;2NA;
(2)用“双线桥”法表示反应中电子转移的方向和数目为 ,氧化产物是2molS,还原产物是1molS,所以氧化产物与还原产物的物质的量之比为2:1,故答案为:
,氧化产物是2molS,还原产物是1molS,所以氧化产物与还原产物的物质的量之比为2:1,故答案为: i;2:1;
i;2:1;
(3)RO3n-+6I-+6H+═R-+3I2+3H2O中,根据电荷守恒,知道n=1,所有碘元素的化合价共升高了6价,反应转移电子为6mol,所以R共降低6价,RO3-中R的化合价为+5价,故答案为:1;+5.
 ,当生成5mol×71g/mol=355g的氯气时,转移的电子为10mol,当生成71克(1mol)Cl2生成,转移的电子为2mol,即2NA个,故答案为:
,当生成5mol×71g/mol=355g的氯气时,转移的电子为10mol,当生成71克(1mol)Cl2生成,转移的电子为2mol,即2NA个,故答案为: ;2NA;
;2NA;(2)用“双线桥”法表示反应中电子转移的方向和数目为
 ,氧化产物是2molS,还原产物是1molS,所以氧化产物与还原产物的物质的量之比为2:1,故答案为:
,氧化产物是2molS,还原产物是1molS,所以氧化产物与还原产物的物质的量之比为2:1,故答案为: i;2:1;
i;2:1;(3)RO3n-+6I-+6H+═R-+3I2+3H2O中,根据电荷守恒,知道n=1,所有碘元素的化合价共升高了6价,反应转移电子为6mol,所以R共降低6价,RO3-中R的化合价为+5价,故答案为:1;+5.
点评:本题考查学生氧化还原反应的中的有关概念和电子转移知识,综合性较强,难度较大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
下列关于胶体的叙述正确的是( )
| A、溶液是电中性的,胶体是带电的 |
| B、可以用渗析的方法将胶体与溶液分离 |
| C、胶体中的分散质粒子大小在1~10nm之间 |
| D、向煮沸的稀氢氧化钠溶液中滴加饱和和FeC13溶液配制Fe(OH)3胶体 |
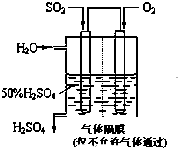 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知: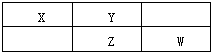 X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示: