题目内容
FeCl3在选修四中出现的次数较多,可见其重要性.
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2 溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是 ,画出无催化剂和有催化剂的能量-反应进程对比图,并作必要的文字注明
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色.将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是 ,从化学平衡常数的角度加以分析(温度不变,假设后加入的FeCl3溶液和稀KSCN溶液都是各自起始浓度的10倍)
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色.限用FeCl3、KSCN、KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行 次实验.
A.1 B.2 C.3 D.4
(4)实验室配制和保存FeCl3溶液,要向其中加入 ,防止其水解变质.
(5)0.1mol?L-1FeCl3溶液中的c(Fe3+) 比0.1mol?L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+) .
(1)在演示催化剂对化学反应速率的影响实验中,向H2O2 溶液中分别滴入FeCl3溶液和CuSO4溶液,催化效果更好的是
(2)在演示增加反应物浓度对化学平衡的影响实验中,稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色.将该浅血红色分成两等份,分别加入同浓度的FeCl3溶液和稀KSCN溶液,红色变得更深的是
(3)分别取若干毫升稀FeCl3溶液与稀KSCN溶液混合,溶液呈较浅血红色.限用FeCl3、KSCN、KCl三种化学药品,为证明FeCl3溶液与KSCN溶液的反应是一个可逆反应,至少还要进行
A.1 B.2 C.3 D.4
(4)实验室配制和保存FeCl3溶液,要向其中加入
(5)0.1mol?L-1FeCl3溶液中的c(Fe3+) 比0.1mol?L-1 (NH4)Fe(SO4)2溶液中的c(Fe3+)
考点:反应热和焓变,化学平衡的影响因素,盐类水解的应用
专题:基本概念与基本理论,元素及其化合物
分析:(1)Fe3+和Cu2+对H2O2的分解也具有催化作用,Fe3+催化作用较好,此反应为放热反应,催化剂对反应热无影响;
(2)平衡为:Fe3++3SCN-?Fe(SCN)3,根据平衡常数分析比较;
(3)可逆反应的特点是不能进行到底.三氯化铁中加入硫氰化钾,充分反应后若仍有三价铁离子和硫氰化钾,则说明该反应为可逆反应;
(4)盐酸可抑制FeCl3溶液水解,又可少引入杂质离子;
(5)铵根离子水解抑制了铁离子水解程度;
(2)平衡为:Fe3++3SCN-?Fe(SCN)3,根据平衡常数分析比较;
(3)可逆反应的特点是不能进行到底.三氯化铁中加入硫氰化钾,充分反应后若仍有三价铁离子和硫氰化钾,则说明该反应为可逆反应;
(4)盐酸可抑制FeCl3溶液水解,又可少引入杂质离子;
(5)铵根离子水解抑制了铁离子水解程度;
解答:
解;(1)Fe3+和Cu2+对H2O2的分解也具有催化作用,Fe3+催化时气体逸出速率较快,催化作用较好.此反应为放热反应,催化剂对反应热无影响,可降低反应的活化能, ,
,
故答案为:FeCl3溶液;
 ;
;
(2)根据平衡移动原理Fe3++3SCN-?Fe(SCN)3,当加入等浓度的稀KSCN溶液时,平衡常数分母增大的更多,而化学平衡常数不变,Fe(SCN)3浓度更大,
故答案为:KSCN溶液;
(3)可逆反应的特点是不能进行到底.三氯化铁中加入硫氰化钾,充分反应后若仍有三价铁离子和硫氰化钾,则说明该反应为可逆反应,因此需加入三氯化铁或硫氰化钾若混合物颜色都加深,证明平衡发生了移动,即两种反应物都还存在,
故答案为:B;
(4)盐酸可抑制FeCl3溶液水解,又可少引入杂质离子,
故答案为:盐酸;
(5)0.1mol?L-1FeCl3溶液和0.1mol?L-1 (NH4)Fe(SO4)2溶液相对较,铵根离子水解抑制了铁离子水解程度,因此后者c(Fe3+)更大,
故答案为:小.
 ,
,故答案为:FeCl3溶液;
 ;
;(2)根据平衡移动原理Fe3++3SCN-?Fe(SCN)3,当加入等浓度的稀KSCN溶液时,平衡常数分母增大的更多,而化学平衡常数不变,Fe(SCN)3浓度更大,
故答案为:KSCN溶液;
(3)可逆反应的特点是不能进行到底.三氯化铁中加入硫氰化钾,充分反应后若仍有三价铁离子和硫氰化钾,则说明该反应为可逆反应,因此需加入三氯化铁或硫氰化钾若混合物颜色都加深,证明平衡发生了移动,即两种反应物都还存在,
故答案为:B;
(4)盐酸可抑制FeCl3溶液水解,又可少引入杂质离子,
故答案为:盐酸;
(5)0.1mol?L-1FeCl3溶液和0.1mol?L-1 (NH4)Fe(SO4)2溶液相对较,铵根离子水解抑制了铁离子水解程度,因此后者c(Fe3+)更大,
故答案为:小.
点评:本题考查了反应热、催化剂、化学平衡、盐类水解等知识,为高考高频重要考点,题目综合性较强,难度一般,掌握好化学原理的运用是解题关键.

练习册系列答案
 轻巧夺冠周测月考直通中考系列答案
轻巧夺冠周测月考直通中考系列答案
相关题目
 如图所示的甲、乙、丙三种晶体,试写出:
如图所示的甲、乙、丙三种晶体,试写出: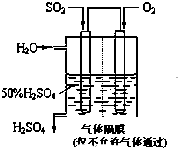 利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知:
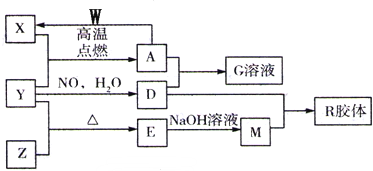
利用催化氧化反应将SO2转化为SO3是工业上生产硫酸的关键步骤.已知: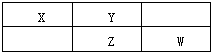 X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示:
X、Y、Z、W为四种常见的短周期元素.其中Y元素原子核外最外层电子数是其电子层数的3倍,它们在周期表中的相对位置如图所示: