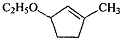
题目内容
反应Fe(s)+CO2(g)?FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
考点:浓度、温度、催化剂对化学反应速率的影响,吸热反应和放热反应,化学平衡常数的含义
专题:
分析:A.升高温度,正逆反应速率都增大;
B.平衡常数K=
;
C.当反应达到平衡状态时,该物质的含量不变、同一物质的正逆反应速率相等及由此衍生的物理量不再变化;
D.升高温度,平衡向吸热反应方向移动,据此判断即可.
B.平衡常数K=
| c(CO) |
| c(CO2) |
C.当反应达到平衡状态时,该物质的含量不变、同一物质的正逆反应速率相等及由此衍生的物理量不再变化;
D.升高温度,平衡向吸热反应方向移动,据此判断即可.
解答:
解:A.无论可逆反应是吸热反应还是放热反应,升高温度,正逆反应速率都增大,只是增大倍数不等,故A错误;
B.平衡常数K=
,故B错误;
C.该可逆反应存在热量变化,当绝热容器中进行该反应,温度不再变化,说明该反应正逆反应速率相等,则达到化学平衡状态,故C正确;
D.升高温度,平衡常数增大,说明平衡向正反应方向移动,则正反应是吸热反应,故D错误;
故选C.
B.平衡常数K=
| c(CO) |
| c(CO2) |
C.该可逆反应存在热量变化,当绝热容器中进行该反应,温度不再变化,说明该反应正逆反应速率相等,则达到化学平衡状态,故C正确;
D.升高温度,平衡常数增大,说明平衡向正反应方向移动,则正反应是吸热反应,故D错误;
故选C.
点评:本题考查了化学平衡常数的有关知识,根据化学平衡常数与温度的关系确定反应热,再结合可逆反应平衡状态的判断依据、化学平衡常数表达式等知识点来分析解答,注意:化学平衡常数表达式中只有气体,为易错点.

练习册系列答案
相关题目
元素性质呈现周期性变化的根本原因是( )
| A、原子半径呈周期性变化 |
| B、元素化合价呈周期性变化 |
| C、电子层数逐渐增加 |
| D、元素原子的核外电子排布呈周期性变化 |
糕点包装中常见的脱氧剂组成:还原性铁粉、氯化钠、炭粉等.脱氧过程中( )
| A、发生析氢腐蚀 |
| B、铁粉作阴极发生氧化反应 |
| C、含有1.12g铁粉的脱氧剂,理论上最多能吸收氧气336mL(标准状况) |
| D、可以吸热,从而降低温度,起保鲜糕点的作用 |
某原电池装置如图所示.电池总反应为:2Ag+Cl2═2AgCl.下列说法正确的是( )

| A、正极反应为Cl2-2e-=2Cl- |
| B、放电时H+从右侧经阳离子交换膜移向左侧 |
| C、电路中转移0.01 mole-时,交换膜左侧溶液中减少0.01 mol离子 |
| D、若用NaCl溶液代替盐酸,电池的总反应不会改变 |


 ②苯环上有两个取代基,且处于对位
②苯环上有两个取代基,且处于对位
 CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
CO中的C与O之间为叁键连接,则CO中碳氧叁键的键能是
 (其中-x、一y均为官能团).请回答下列问题:
(其中-x、一y均为官能团).请回答下列问题: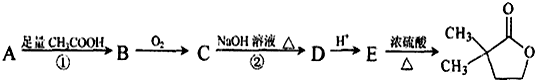
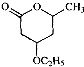 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从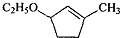 到
到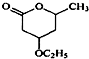 的合成路线(用流程图表示,并注明反应条件).
的合成路线(用流程图表示,并注明反应条件).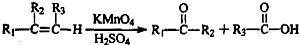 ;
; .
.