题目内容
某药物中间体合成路线如下(部分反应条件和产物略) 
(1)写出下列物质的结构简式:A ,D .
(2)反应①、②的目的是 .
(3)写出满足下列条件的A的一种同分异构体的结构简式 .
a.不溶于水 b.能发生银镜反应 c.含有一C(CH3)3
(4)写出B→C反应的化学方程式为 .
(5) 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从 到
到 的合成路线(用流程图表示,并注明反应条件).
的合成路线(用流程图表示,并注明反应条件).
提示:① ;
;
②合成过程中无机试剂任选;
③合成路线流程图示例如下:
CH3CH2OH
CH2=CH2
 .
.
合成路线:
.

(1)写出下列物质的结构简式:A
(2)反应①、②的目的是
(3)写出满足下列条件的A的一种同分异构体的结构简式
a.不溶于水 b.能发生银镜反应 c.含有一C(CH3)3
(4)写出B→C反应的化学方程式为
(5)
 是B的一种重要的同分异构体.请设计合理方案,完成从
是B的一种重要的同分异构体.请设计合理方案,完成从 到
到 的合成路线(用流程图表示,并注明反应条件).
的合成路线(用流程图表示,并注明反应条件).提示:①
 ;
;②合成过程中无机试剂任选;
③合成路线流程图示例如下:
CH3CH2OH
| 浓硫酸 |
| 170℃ |
| 高温、高压 |
| 催化剂 |
 .
.合成路线:

| H2O |
| 催化剂 |
考点:有机物的合成
专题:有机物的化学性质及推断
分析:由产物 可知E的结构简式为:HOCH2CH2C(CH3)2COOH,D酸化达到E,则D为HOCH2CH2C(CH3)2COONa;C在NaOH的水溶液中发生水解生成D,则C为CH3COOCH2CH2C(CH3)2COOH;B经过氧化得到C,则B为CH3COOCH2CH2C(CH3)2CHO;A与乙酸发生酯化反应生成B,则A为HOCH2CH2C(CH3)2CHO,结合对应有机物的结构和性质以及题目要求可解答该题.
可知E的结构简式为:HOCH2CH2C(CH3)2COOH,D酸化达到E,则D为HOCH2CH2C(CH3)2COONa;C在NaOH的水溶液中发生水解生成D,则C为CH3COOCH2CH2C(CH3)2COOH;B经过氧化得到C,则B为CH3COOCH2CH2C(CH3)2CHO;A与乙酸发生酯化反应生成B,则A为HOCH2CH2C(CH3)2CHO,结合对应有机物的结构和性质以及题目要求可解答该题.
 可知E的结构简式为:HOCH2CH2C(CH3)2COOH,D酸化达到E,则D为HOCH2CH2C(CH3)2COONa;C在NaOH的水溶液中发生水解生成D,则C为CH3COOCH2CH2C(CH3)2COOH;B经过氧化得到C,则B为CH3COOCH2CH2C(CH3)2CHO;A与乙酸发生酯化反应生成B,则A为HOCH2CH2C(CH3)2CHO,结合对应有机物的结构和性质以及题目要求可解答该题.
可知E的结构简式为:HOCH2CH2C(CH3)2COOH,D酸化达到E,则D为HOCH2CH2C(CH3)2COONa;C在NaOH的水溶液中发生水解生成D,则C为CH3COOCH2CH2C(CH3)2COOH;B经过氧化得到C,则B为CH3COOCH2CH2C(CH3)2CHO;A与乙酸发生酯化反应生成B,则A为HOCH2CH2C(CH3)2CHO,结合对应有机物的结构和性质以及题目要求可解答该题.解答:
解:由产物可知E为HOCH2CH2C(CH3)2COOH,则D为HOCH2CH2C(CH3)2COONa,C为CH3COOCH2CH2C(CH3)2COOH,B为CH3COOCH2CH2C(CH3)2CHO,则A为HOCH2CH2C(CH3)2CHO,
(1)根据以上分析可知,A为HOCH2CH2C(CH3)2CHO,D为HOCH2CH2C(CH3)2COONa,
故答案为:HOCH2CH2C(CH3)2CHO;HOCH2CH2C(CH3)2COONa;
(2)A为HOCH2CH2C(CH3)2CHO,A中含有羟基,可被氧化,则反应①、②的目的是保护-OH不被氧化,
故答案为:保护-OH不被氧化;
(3)A为HOCH2CH2C(CH3)2CHO,A的一种同分异构体不溶于水,应含有酯基,能发生银镜反应,则含有醛基,则该有机物应为甲酸酯,
且含有一C(CH3)3,所以满足条件的有机物的结构简式为:HCOOCH2C(CH3)3,
故答案为:HCOOCH2C(CH3)3;
(4)B为CH3COOCH2CH2C(CH3)2CHO,在催化剂条件下可被氧化为酸,反应的化学方程式为:2CH3COOCH2CH2C(CH3)2CHO+O2
2CH3COOCH2CH2C(CH3)2COOH,
故答案为:2CH3COOCH2CH2C(CH3)2CHO+O2
2CH3COOCH2CH2C(CH3)2COOH;
(5) 可先与水发生加成反应,然后在浓硫酸作用下发生消去反应,用高锰酸钾氧化后在与氢气发生加成反应,最后在浓硫酸作用下发生酯化反应可得到产物,反应的流程为:
可先与水发生加成反应,然后在浓硫酸作用下发生消去反应,用高锰酸钾氧化后在与氢气发生加成反应,最后在浓硫酸作用下发生酯化反应可得到产物,反应的流程为: ,
,
故答案为: .
.
(1)根据以上分析可知,A为HOCH2CH2C(CH3)2CHO,D为HOCH2CH2C(CH3)2COONa,
故答案为:HOCH2CH2C(CH3)2CHO;HOCH2CH2C(CH3)2COONa;
(2)A为HOCH2CH2C(CH3)2CHO,A中含有羟基,可被氧化,则反应①、②的目的是保护-OH不被氧化,
故答案为:保护-OH不被氧化;
(3)A为HOCH2CH2C(CH3)2CHO,A的一种同分异构体不溶于水,应含有酯基,能发生银镜反应,则含有醛基,则该有机物应为甲酸酯,
且含有一C(CH3)3,所以满足条件的有机物的结构简式为:HCOOCH2C(CH3)3,
故答案为:HCOOCH2C(CH3)3;
(4)B为CH3COOCH2CH2C(CH3)2CHO,在催化剂条件下可被氧化为酸,反应的化学方程式为:2CH3COOCH2CH2C(CH3)2CHO+O2
| 催化剂 |
故答案为:2CH3COOCH2CH2C(CH3)2CHO+O2
| 催化剂 |
(5)
 可先与水发生加成反应,然后在浓硫酸作用下发生消去反应,用高锰酸钾氧化后在与氢气发生加成反应,最后在浓硫酸作用下发生酯化反应可得到产物,反应的流程为:
可先与水发生加成反应,然后在浓硫酸作用下发生消去反应,用高锰酸钾氧化后在与氢气发生加成反应,最后在浓硫酸作用下发生酯化反应可得到产物,反应的流程为: ,
,故答案为:
 .
.
点评:本题考查有机物的合成,题目难度中等,利用逆推法推断E结构为解答该题的关键,做题中注意把握题给信息,注意熟练掌握常见有机物结构与性质.

练习册系列答案
 阅读快车系列答案
阅读快车系列答案
相关题目
反应Fe(s)+CO2(g)?FeO(s)+CO(g),700℃时平衡常数为1.47,900℃时平衡常数为2.15.下列说法正确的是( )
| A、升高温度该反应的正反应速率增大,逆反应速率减小 | ||
B、该反应的化学平衡常数表达式为K=
| ||
| C、绝热容器中进行该反应,温度不再变化,则达到化学平衡状态 | ||
| D、该反应的正反应是放热反应 |
下列有关说法正确的是( )
| A、H7N9型禽流感是一种新型禽流感,流感病毒通常检测方法是基于核酸检测的原理.核酸一种是蛋白质 |
| B、侯德榜发明了侯氏制碱法、维勒用氮气和氢气合成了氨气、阿伦尼乌斯创立了电离学说、扫描隧道显微镜的发明和STM技术应用等等,这些都对化学学科的应用和发展作出了重要的贡献 |
| C、使用可再生资源、注重原子的经济性、推广利用二氧化碳与环氧丙烷生成的生物降解材料等都是绿色化学的内容 |
| D、化学帮助人类创造和合成了大量材料,如高纯硅制作太阳能电池、聚氯乙烯塑料用来食品包装、人造刚玉Al2O3用作耐高温材料等等 |
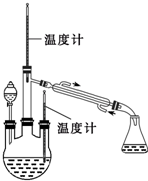 肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl
肼是重要的化工原料.某探究小组利用下列反应制取水合肼(N2H4?H2O).CO(NH2)+2NaOH+NaClO=Na2CO3+N2H4?H2O+NaCl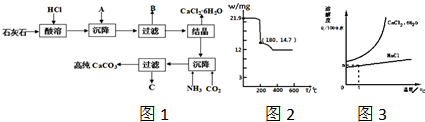
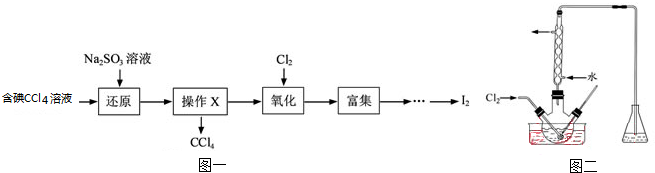
 )
)
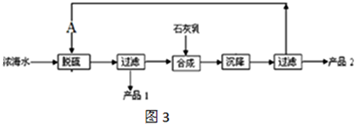
 煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.
煤化工是以煤为原料,经过化学加工使煤转化为气体、液体、固体燃料以及各种化工产品的工业过程.