题目内容
17. 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.实验原理:CH3CH2Br+NaOH $→_{△}^{醇}$CH2=CH2↑+NaBr+H2O
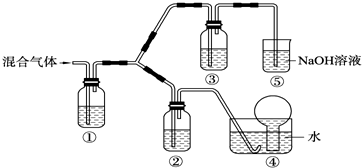
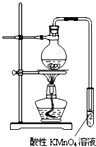
实验过程:组装如图所示装置,检查装置气密性,向烧瓶中注入10mL溴乙烷和15mL饱和氢氧化钠乙醇溶液,微热,观察实验现象.一段时间后,观察到酸性KMnO4溶液颜色褪去.
(1)甲同学认为酸性KMnO4溶液颜色褪去说明溴乙烷发生了消去反应,生成了乙烯;而乙同学却认为甲同学的说法不严谨,请说明原因:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色;改进实验装置后,再次进行实验,却又发现小试管中溶液颜色褪色不明显.该小组再次查阅资料,对实验进行进一步的改进.
资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%.
资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快.
资料三:溴乙烷的沸点:38.2℃.
(2)结合资料一、二可知,丙同学改进实验装置后,溶液颜色褪色不明显的原因可能是反应温度较低,此时发生反应的化学方程式为:H3CH2Br+NaOH
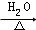 CH3CH2OH+NaBr.
CH3CH2OH+NaBr.(3)结合资料二、三,你认为还应该在实验装置中增加的两种仪器是①冷凝管 ②量程为200℃温度计.
分析 (1)从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,所以使酸性KMnO4溶液颜色褪去不一定是产生的乙烯在作用;
(2)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%不难分析原因;
(3)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管.
解答 解:(1)因为乙醇具有挥发性,所以从反应装置出来的气体除了生成的乙烯外还有挥发出来的乙醇,乙烯和乙醇都可以使酸性KMnO4溶液颜色褪去,故不一定是产生的乙烯,故答案为:乙醇易挥发,挥发出来的乙醇也可以使酸性KMnO4溶液褪色;
(2)根据改进实验装置后,溶液颜色褪色不明显,说明生成的乙烯量很少,结合资料一:溴乙烷于55℃时,在饱和氢氧化钠的乙醇溶液中发生取代反应的产物的百分比为99%,而消去反应产物仅为1%,所以应该是反应温度较低主要发生了取代反应,方程式为:CH3CH2Br+NaOH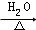 CH3CH2OH+NaBr,
CH3CH2OH+NaBr,
故答案为:反应温度较低;CH3CH2Br+NaOH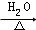 CH3CH2OH+NaBr;
CH3CH2OH+NaBr;
(3)根据资料二:溴乙烷发生消去反应比较适宜的反应温度为90℃~110℃,在该范围,温度越高,产生乙烯的速率越快,说明要产生乙烯要控制温度在90℃~110℃,所以需要一个量程为200℃温度计,再根据资料三:溴乙烷的沸点:38.2℃,所以在制得的乙烯中会含有溴乙烷气体的杂质,需要冷凝除去,所以需要冷凝管,
故答案为:冷凝管;量程为200℃温度计.
点评 本题考查了探究物质的组成实验方案设计,侧重于探究溴乙烷的消去反应的条件并验证产物,培养学生提取信息的能力,并利用好这些信息来设计好实验,题目难度中等.

 名校课堂系列答案
名校课堂系列答案| A. | 加明矾使海水中的盐分沉淀而淡化 | |
| B. | 利用太阳能使海水蒸馏淡化 | |
| C. | 将海水缓慢凝固以获取淡化的饮用水 | |
| D. | 将海水通过离子交换树脂,以除去所含离子 |
| A. | Na+、Al3+、SO42-、HCO3- | B. | Cu2+、Mg2+、SO42-、NO3- | ||
| C. | Na+、K+、ClO-、SO42- | D. | Fe3+、K+、SO42-、I- |
| 选项 | 实验 | 现象 | 结论 |
| A | 用酒精灯加热摩尔盐(NH4)2Fe(SO4)2•6H2O,产生的气体通过装有无水硫酸铜的干燥管 | 干燥管中的白色粉末先变成天蓝色,后又变成深蓝色 | 加热温度较低时摩尔盐分解产生水蒸气,温度稍高时分解产物中有氨气 |
| B | 向某溶液中滴加BaCl2溶液,随后加稀硝酸酸化 | 溶液中产生白色沉淀,加稀硝酸不溶解 | 原溶液中一定含有SO42- |
| C | 向CuSO4溶液中通入H2S气体 | 溶液的蓝色褪去,生成黑色沉淀 | 氢硫酸的酸性比硫酸强 |
| D | 将干燥的氯气通入放有鲜花的瓶中 | 鲜花褪色 | 说明氯气具有漂白性 |
| A. | A | B. | B | C. | C | D. | D |
| A. | 硫化氢分子的电子式: | B. | S2-的结构示意图: | ||
| C. | HClO的结构式:H-O-Cl | D. | NH4Cl的电子式: |
| A. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | SO2通入新制氯水中:SO2+Cl2+2H2O═SO42-+2Cl-+4H+ | |
| D. | 向KAl(SO4)2溶液中滴入Ba(OH)2恰好使Al3+完全沉淀:Ba2++3OH-+Al3++SO42-═BaSO4↓+Al(OH)3↓ |
| A. | 滴定管的润洗是向滴定管中加入少量要盛装的溶液,边旋转边倾斜使溶液润湿全部内壁后从上口倒出 | |
| B. | 中和热的测定需要使用两个量筒分别量取酸碱溶液体积,使用两个温度计分别测定开始和终点的溶液温度 | |
| C. | 用密度为1.84g/cm3的浓硫酸配制100mL的2mol/L的稀硫酸,需要计算并称量浓硫酸的质量 | |
| D. | 用重结晶法提纯粗苯甲酸时,溶解度较小的杂质趁热过滤时留在了滤纸上,溶解度较大的杂质冷却结晶时留在了母液里 |
| A. | CO2和SiO2化学键类型相同,晶体类型不同 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| D. | 氯化钠熔化时离子键未被破坏 |