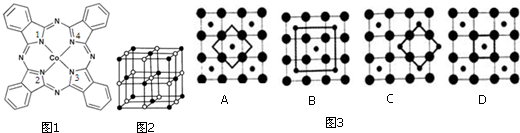
题目内容
7.下列有关说法正确的是( )| A. | CO2和SiO2化学键类型相同,晶体类型不同 | |
| B. | 碘晶体受热转变成碘蒸气,吸收的热量用于克服碘原子间的作用力 | |
| C. | 氯化氢溶于水能电离出H+、Cl-,所以氯化氢是离子化合物 | |
| D. | 氯化钠熔化时离子键未被破坏 |
分析 A.CO2和SiO2的化学键类型相同,均为共价键,但晶体类型不同,前者是分子晶体,后者是原子晶体;
B.碘晶体属于分子晶体;
C.由阳离子和阴离子通过离子键构成的化合物为离子化合物;
D.氯化钠属于离子晶体熔化时离子键被破坏.
解答 解:A.CO2和SiO2的化学键类型相同,均为共价键,但晶体类型不同,前者是分子晶体,后者是原子晶体,故A正确;
B.碘晶体属于分子晶体,碘晶体受热转变成碘蒸气,吸收的热量用于克服分子间作用力,故B错误;
C.氯化氢是原子间通过共用电子对形成的共价化合物,氯化氢溶于水能电离出H+、Cl-,说明氯化氢是电解质,故C错误;
D.氯化钠属于离子晶体,熔化时离子键被破坏,故D错误;
故选A.
点评 本题考查化学键、晶体类型等知识点,侧重考查基本概念,明确物质的构成微粒、物质中存在的化学键即可解答,题目难度不大.

练习册系列答案
 小题狂做系列答案
小题狂做系列答案
相关题目
18.除去下列物质中的杂质,采用的试剂和除杂方法中有错误的是( )
| 序号 | 待除杂质(括号中为杂质) | 试剂 | 除杂方法 |
| A | 苯甲酸固体(NaCl固体) | 蒸馏水 | 重结晶 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 酒精(水) | 生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
15.下列说法不正确的是( )
| A. | 按系统命名法,化合物  的名称为2-甲基-3,4-二乙基己烷 的名称为2-甲基-3,4-二乙基己烷 | |
| B. |  与 与 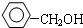 互为 同系物 互为 同系物 | |
| C. | 下列物质的沸点按由低到高顺序为:(CH3)2CHCH3<(CH3)4C<(CH3)2CHCH2CH3<CH3(CH2)3CH3 | |
| D. | 等质量的甲烷、乙醇、乙醛分别充分燃烧,所耗用氧气的量依次减小 |
2.下列化学用语正确的是( )
| A. | 二氧化碳的结构式:O=C=O | |
| B. | 硫酸的电离方程式:H2SO4=H++SO42- | |
| C. | Cl-的结构示意图: | |
| D. | HF的电子式:H+ |
12.用NA表示阿伏加德罗常数的值.下列判断正确的是( )
| A. | 18gH2O含有的氢原子数目为NA | |
| B. | 常温常压下,22.4L CO2含有的分子数目为NA | |
| C. | 1mol钠在空气中充分燃烧失去的电子数目为NA | |
| D. | 1mol•L-1Na2SO4溶液中含有的钠离子数目为2NA |
19.下列物质都有漂白性,其漂泊原理与另外三个差别最大的是( )
| A. | SO2 | B. | Na2O2 | C. | 漂白粉 | D. | 氯水 |
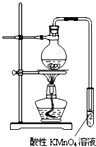 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.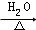 CH3CH2OH+NaBr.
CH3CH2OH+NaBr.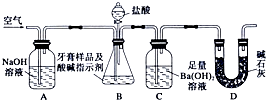 化学兴趣小组对某品牌牙膏中磨擦剂成分及其含量进行以下探究:
化学兴趣小组对某品牌牙膏中磨擦剂成分及其含量进行以下探究: