题目内容
9.下列离子方程式正确的是( )| A. | 少量金属钠放入冷水中:Na+2H2O═Na++2OH-+H2↑ | |
| B. | 稀硝酸与过量的铁屑反应:3Fe+8H++2NO3-═3Fe3++2NO↑+4H2O | |
| C. | SO2通入新制氯水中:SO2+Cl2+2H2O═SO42-+2Cl-+4H+ | |
| D. | 向KAl(SO4)2溶液中滴入Ba(OH)2恰好使Al3+完全沉淀:Ba2++3OH-+Al3++SO42-═BaSO4↓+Al(OH)3↓ |
分析 A.2mol钠与水反应生成1mol氢气,该反应不满足电子守恒、电荷守恒;
B.铁屑过量,反应生成亚铁离子;
C.二氧化硫与氯水发生氧化还原反应生成硫酸和氯化氢;
D.铝离子完全沉淀时,硫酸铝钾与氢氧化钡的物质的量制备为2:3,据此判断该离子方程式.
解答 解:A.少量金属钠放入冷水中,二者反应生成氢氧化钠和氢气,正确的离子方程式为:2Na+2H2O═2Na++2OH-+H2↑,故A错误;
B.稀硝酸与过量的铁屑反应生成硝酸亚铁、NO气体和水,正确的离子方程式为:3Fe+8H++2NO3-═3Fe2++2NO↑+4H2O,故B错误;
C.SO2通入新制氯水中,二者发生氧化还原反应,反应的离子方程式为:SO2+Cl2+2H2O═SO42-+2Cl-+4H+,故C正确;
D.KAl(SO4)2溶液中滴入Ba(OH)2恰好使Al3+完全沉淀,硫酸铝钾与氢氧化钡按照物质的量2:3反应,正确的离子方程式为:3Ba2++6OH-+2Al3++3SO42-═3BaSO4↓+2Al(OH)3↓,故D错误;
故选C.
点评 本题考查了离子方程式的判断,为高考的高频题,属于中等难度的试题,注意明确离子方程式正误判断常用方法:检查反应物、生成物是否正确,检查各物质拆分是否正确,如难溶物、弱电解质等需要保留化学式,检查是否符合守恒关系(如:质量守恒和电荷守恒等)等.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
19.下列事实能判断金属元素甲的金属性一定比乙强的有( )
①甲单质能与乙盐的溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
①甲单质能与乙盐的溶液反应
②甲、乙两元素原子的最外层电子数相同,且甲的原子半径小于乙
③甲、乙两短周期元素原子的电子层数相同,且甲的原子序数小于乙
④甲、乙两元素的单质和盐酸组成原电池,乙单质表面生成氢气
⑤两单质分别与氯气反应时生成的阳离子,甲失去的电子数比乙多.
| A. | 全部可以 | B. | 仅②不可以 | C. | 仅②⑤不可以 | D. | ③④可以 |
4.下列有关实验操作不正确的是( )
| A. | 用酒精萃取碘水中的碘 | |
| B. | 丁达尔效应可以区分胶体与溶液 | |
| C. | 化合物氯化钾灼烧透过蓝色钴玻璃片观察为紫色 | |
| D. | 检验氨气是否集满,用湿润的红色石蕊试纸放在集气瓶口 |
14.绿色能源是指使用不会对环境造成污染的能源.下列属于绿色能源的是( )
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
①太阳能 ②风能 ③潮汐能 ④煤 ⑤天然气 ⑥石油.
| A. | ①②③ | B. | ③④ | C. | ④ | D. | ①② |
1.一定条件下,在体积一定的密闭容器中加入1molN2和3molH2发生反应:N2+3H2$?_{高温高压}^{催化剂}$2NH3(正反应是放热反应).下列有关说法正确的是( )
| A. | 达到化学反应限度时,生成2mol NH3 | |
| B. | 向容器中再加入N2,可以加快反应速率 | |
| C. | 降低温度可以加快反应速率 | |
| D. | 1mol N2 和3mol H2的总能量低于2mol NH3的总能量 |
18.除去下列物质中的杂质,采用的试剂和除杂方法中有错误的是( )
| 序号 | 待除杂质(括号中为杂质) | 试剂 | 除杂方法 |
| A | 苯甲酸固体(NaCl固体) | 蒸馏水 | 重结晶 |
| B | 乙烷(乙烯) | 酸性高锰酸钾溶液 | 洗气 |
| C | 酒精(水) | 生石灰 | 蒸馏 |
| D | 苯(苯酚) | 浓溴水 | 过滤 |
| A. | A | B. | B | C. | C | D. | D |
19.下列物质都有漂白性,其漂泊原理与另外三个差别最大的是( )
| A. | SO2 | B. | Na2O2 | C. | 漂白粉 | D. | 氯水 |
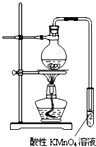 某学习小组探究溴乙烷的消去反应并验证产物.
某学习小组探究溴乙烷的消去反应并验证产物.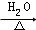 CH3CH2OH+NaBr.
CH3CH2OH+NaBr.