题目内容
11.将500mL(标准状况)含有CO的某气体样品通过盛有足量I2O5的干燥管,170℃下充分反应,用水-乙醇液充分溶解产物I2,定容到100mL.取20.00mL,用0.0100mol•L-1 Na2S2O3标准溶液滴定,消耗标准溶液20.00mL.(1)请写出Na2S2O3溶液与I2反应的化学方程式:2Na2S2O3+I2=Na2S4O6+2NaI.
(2)定容时会用到的玻璃仪器是:胶头滴管,100ml容量瓶
(3)样品气中CO的体积分数为11.2%.(已知:气体样品中其他成分与I2O5不反应,Na2S2O3反应产物为Na2S4O6)
分析 (1)根据题目信息以及质量守恒可知Na2S2O3与I2反应生成为Na2S4O6和NaI,然后配平;
(2)胶头滴管是在容量瓶定容的时候,加水至刻度线还有1-2厘米时用胶头滴管滴加直至刻度线;
(3)根据题目信息可知:5CO+I2O5=5CO2+I2和2Na2S2O3+I2=2NaI+Na2S4O6列关系式得:5CO~I2~2Na2S2O3,然后计算即可.
解答 解:(1)由题目信息以及质量守恒可知Na2S2O3与I2反应生成为Na2S4O6和NaI,方程式为:2Na2S2O3+I2=Na2S4O6+2NaI;
故答案为:2Na2S2O3+I2=Na2S4O6+2NaI;
(2)定容时会用到的玻璃仪器是胶头滴管,100ml容量瓶;
故答案为:胶头滴管,100ml容量瓶;
(3)5CO+I2O5=5CO2+I2和2Na2S2O3+I2=2NaI+Na2S4O6列关系式得:
5CO~~I2~~~2Na2S2O3
5 2
n(CO) 0.0100mol•L-1×0.02×$\frac{100}{20}$
解得n(CO)=0.0025mol V(CO)=0.0025mol×22.4L/mol=0.056L=56mL
则样品气中CO的体积分数为:$\frac{56mL}{500mL}$×100%=11.2%,
故答案为:11.2%.
点评 本题考查氧化还原反应及计算,把握关系式为解答的关键,侧重氧化还原反应配平及计算的考查,题目难度不大,综合性较强.

练习册系列答案
相关题目
16.图是一种分子式为C4H8O2的有机物的红外光谱图,则该有机物可能为( )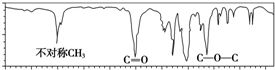

| A. | CH3COOCH2CH3 | B. | CH3CH2COOH | C. | HCOOCH2CH2CH3 | D. | (CH3)2CHCH2COOH |
3.如今人们把食品分为绿色食品、蓝色食品、白色食品等类型.绿色植物通过光合作用转化的食品叫绿色食品;而直接从海洋获取的食品叫蓝色食品;通过微生物发酵制得的食品叫白色食品.下面属于白色食品的是( )
| A. | 海带 | B. | 食盐 | C. | 面粉 | D. | 酸奶 |
20.下列离子方程式书写正确的是( )
| A. | 过量的SO2 通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| C. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
1.下列化合物分子中只有σ键的是( )
| A. | CO2 | B. | C2H2 | C. | H2O2 | D. | COCl2 |