题目内容
16.0.5molH2CO3中含有1.5 mol的O、1mol的H、3.01×1023个C、共有1.806×1024个原子.分析 每个H2CO3含有2个H原子、1个C原子、3个O原子,氢原子物质的量为碳酸的2倍,氧原子物质的量为碳酸的3倍,再根据N=nNA计算含有C原子数目,计算原子总物质的量,再根据N=nNA计算原子总数目.
解答 解:每个H2CO3含有2个H原子、1个C原子、3个O原子,则:
n(O)=3n(H2CO3)=0.5mol×3=1.5mol
n(H)=2n(H2CO3)=0.5mol×2=1mol
n(C)=n(H2CO3)=0.5mol,
故N(C)=0.5mol×6.02×1023mol-1=3.01×1023,
含有原子总物质的量为1.5mol+1mol+0.5mol=3mol,含有原子总数目为3mol×6.02×1023mol-1=1.806×1024,
故答案为:1.5;1;3.01×1023;1.806×1024.
点评 本题考查物质的量有关计算,侧重考查微粒数目计算,比较基础,注意对化学式意义的理解.

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目
6.关于各装置图的叙述中,正确的是( )

| A. | 实验室用装置①制取氨气 | |
| B. | 装置②中X若为四氯化碳,可用于吸收氨气,并防止倒吸 | |
| C. | 装置③可用于制备氢氧化亚铁并观察其颜色 | |
| D. | 装置④b口进气可收集CO2等气体 |
11.下列叙述正确的是( )
| A. | 标准状况下1mol的水所占的体积约为22.4L | |
| B. | 标准状况下2g H2所占的体积约为22.4L | |
| C. | 常温常压下1mol的水所占的体积约为22.4L | |
| D. | 常温常压下2g H2所占的体积约为22.4L |
1.下列物质或微粒用电子式表示的形成过程有误的是( )
| A. | NaCl: | B. | MgBr2: | ||
| C. | Na2S: | D. | CaO: |
8.水玻璃是建筑行业常用的粘合剂,并可用于木材防火和防腐处理.水玻璃为( )
| A. | CaSiO3固体 | B. | SiO2 | C. | Na2SiO3水溶液 | D. | H2SiO3 |
5.有一澄清透明的溶液,可能含有大量的Ag+、Fe3+、Fe2+、A13+、NH${\;}_{4}^{+}$、H+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、Cl-十种离子中的几种,向该溶液中逐滴缓慢加入一定1mol•L-1Na0H溶液,开始产生沉淀并逐渐增多,随后又逐渐减少,整个过程始终无气体放出,则下列判断正确的是( )
| A. | 可能含有Ag+、Al3+、NH${\;}_{4}^{+}$ | |
| B. | 一定不含Cl-,可能含有NO${\;}_{3}^{-}$ | |
| C. | 一定不含AlO${\;}_{2}^{-}$、NH${\;}_{4}^{+}$、CO${\;}_{3}^{2-}$ | |
| D. | 可能含有Fe3+、Fe2+,一定不含AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ |
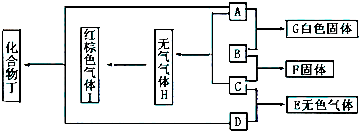
 PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、
PM2.5富含大量的有毒、有害物质,易引发二次光化学烟雾,光化学烟雾中含有NOx、HCOOH、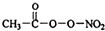 (PAN)等二次污染物.
(PAN)等二次污染物.