题目内容
20.下列离子方程式书写正确的是( )| A. | 过量的SO2 通入NaOH溶液中:SO2+2OH-═SO32-+H2O | |
| B. | NaNO2溶液中加入酸性KMnO4溶液:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O | |
| C. | 硫酸亚铁溶液与过氧化氢溶液混合:Fe2++2H2O2+4H+═Fe3++4H2O | |
| D. | NaHCO3溶液中加入过量Ba(OH)2溶液:2HCO3-+Ba2++2OH-═BaCO3↓+2H2O+CO32 |
分析 A.生成亚硫酸氢钠;
B.NaNO2溶液中加入酸性KMnO4溶液生成硝酸钠和硫酸锰、水;
C.电荷不守恒;
D.NaHCO3溶液中加入过量Ba(OH)2溶液生成碳酸钡和NaOH、水.
解答 解:A.过量的SO2 通入NaOH溶液中生成亚硫酸氢钠,其反应的离子方程式为:SO2+OH-═HSO3-,故A错误;
B.NaNO2溶液中加入酸性KMnO4溶液生成硝酸钠和硫酸锰、水,其反应的离子方程式为:2MnO4-+5NO2-+6H+═2Mn2++5NO3-+3H2O,故B正确;
C.硫酸亚铁溶液与过氧化氢溶液混合,其反应的离子方程式为:2Fe2++H2O2+2H+═2Fe3++2H2O;
D.NaHCO3溶液中加入过量Ba(OH)2溶液生成碳酸钡和NaOH、水,反应的离子方程式为:HCO3-+Ba2++OH-═BaCO3↓+H2O,故D错误.
故选B.
点评 本题考查离子反应方程式的书写,明确发生的化学反应是解答的关键,注意离子反应中保留化学式的物质,题目难度不大.

练习册系列答案
相关题目
5.有一澄清透明的溶液,可能含有大量的Ag+、Fe3+、Fe2+、A13+、NH${\;}_{4}^{+}$、H+、AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$、NO${\;}_{3}^{-}$、Cl-十种离子中的几种,向该溶液中逐滴缓慢加入一定1mol•L-1Na0H溶液,开始产生沉淀并逐渐增多,随后又逐渐减少,整个过程始终无气体放出,则下列判断正确的是( )
| A. | 可能含有Ag+、Al3+、NH${\;}_{4}^{+}$ | |
| B. | 一定不含Cl-,可能含有NO${\;}_{3}^{-}$ | |
| C. | 一定不含AlO${\;}_{2}^{-}$、NH${\;}_{4}^{+}$、CO${\;}_{3}^{2-}$ | |
| D. | 可能含有Fe3+、Fe2+,一定不含AlO${\;}_{2}^{-}$、CO${\;}_{3}^{2-}$ |
8.下列变化属于放热反应的是( )
| A. | 气态水液化 | B. | 酒精燃烧 | ||
| C. | 碳酸钙高温分解 | D. | 氢氧化钡与氯化铵反应 |
15.在水电离出的c(H+)=1×10-14 mol•L-1的溶液中,一定能大量共存的离子组是( )
| A. | K+、Na+、HCO3-、Cl- | B. | K+、AlO2-、Br-、Cl- | ||
| C. | Na+、Cl-、NO3-、SO42- | D. | Al3+、NH4+、Cl-、SO42- |
5.X、Y、Z、W均为短周期元素,X、Y处于同一主族,X的最低价和Z的最高价离子的半径关系为X2->Z2+,W的单质是空气的组成成分之一,且与X、Y、Z均不在同一周期中.下列说法一定正确的是( )
| A. | 原子序数:Z>X>W | |
| B. | 单质的沸点:Z>X | |
| C. | 原子的最外层电子数:Y>W>Z | |
| D. | 标准状况下,5.6LW的单质中含有0.5mol原子 |
12.回答下列问题.
(1)浓硫酸与木炭在加热条件下反应的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+SO2+2H2O
(2)试用如图所列各种装置设计一个实验来验证上述反应所产生的各种产物
这些装置的连接顺序(按产物气流从左至右的方向)是(填装置的编号):4→2→1→3.
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是验证产物中是否有二氧化硫,B瓶溶液的作用是除去二氧化硫,C瓶溶液的作用是确定产物中二氧化硫已经被B瓶溶液除尽.
(4)装置②中所加固体药品是无水硫酸铜,可验证的产物是H2O,确定装置②在整套装置中位置的理由是由于产物气流通过装置1、3带出水蒸气,所以2必须在1、3之前.
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是二氧化碳.
(1)浓硫酸与木炭在加热条件下反应的化学方程式是C+2H2SO4(浓)$\frac{\underline{\;\;△\;\;}}{\;}$CO2+SO2+2H2O
(2)试用如图所列各种装置设计一个实验来验证上述反应所产生的各种产物
| 编号 | ① | ② | ③ | ④ |
| 装置 | 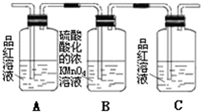 | 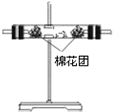 | 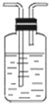 | 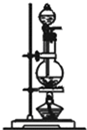 |
(3)实验时可观察到装置①中A瓶的溶液褪色,C瓶的溶液不褪色.A瓶溶液的作用是验证产物中是否有二氧化硫,B瓶溶液的作用是除去二氧化硫,C瓶溶液的作用是确定产物中二氧化硫已经被B瓶溶液除尽.
(4)装置②中所加固体药品是无水硫酸铜,可验证的产物是H2O,确定装置②在整套装置中位置的理由是由于产物气流通过装置1、3带出水蒸气,所以2必须在1、3之前.
(5)装置③中所盛溶液是澄清石灰水,可验证的产物是二氧化碳.
10.甲醇是重要的化工原料,又是一种可再生能源,具有广泛的开发和应用前景.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
则x=1076.
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)
△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图1中a点的平衡常数KP=1.6×10-7(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).
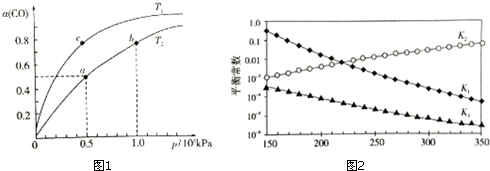
(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$ CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示.则△H1>△H3(填“>”、“<”、“=”),理由是曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
(1)已知反应CO(g)+2H2(g)?CH3OH(g)△H=-99kJ.mol-1中的相关化学键键能如下:
| 化学键 | H-H | C-O | C≡C | H-O | C-H |
| E/(KJ.mol-1) | 436 | 343 | x | 465 | 413 |
(2)在一容积可变的密闭容器中,1molCO与2molH2发生反应:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)
△H1<0,CO在不同温度下的平衡转化率(α)与压强的关系如图1所示.
①a、b两点的反应速率:v(a)<v(b)(填“>”、“<”、“=”)
②T1<T2 (填“>”、“<”、“=”),原因是而正反应是放热反应,温度升高,平衡逆向移动,CO的平衡转化率减小,故Tl<T2.
③在c点条件下,下列叙述能说明上述反应能达到化学平衡状态的是bc(填代号)
a.H2的消耗速率是CH3OH生成速率的2倍
b.CH3OH的体积分数不再改变
c.混合气体的密度不再改变
d.CO和CH3OH的物质的量之和保持不变
④计算图1中a点的平衡常数KP=1.6×10-7(kPa)-2(用平衡分压代替平衡浓度计算,分压=总压×物质的量分数).

(3)利用合成气(主要成分为CO、CO2和H2)合成甲醇,发生的主要反应如下:
I:CO(g)+2H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)△H1
Ⅱ:CO2(g)+H2(g)$\stackrel{催化剂}{?}$ CO(g)+H2O(g)△H2
Ⅲ:CO2(g)+3H2(g)$\stackrel{催化剂}{?}$ CH3OH(g)+H2O(g)△H3
上述反应对应的平衡常数分别为K1、K2、K3,它们随温度变化的曲线如图2所示.则△H1>△H3(填“>”、“<”、“=”),理由是曲图l可知,随着温度升高,K1减小,则△H1<0,根据盖斯定律又得△H3=△H1+△H2,所以△H2>△H3.
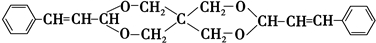
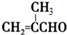 +2Cu(OH)2+NaOH$\stackrel{△}{→}$
+2Cu(OH)2+NaOH$\stackrel{△}{→}$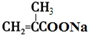 +Cu2O↓+3H2O.
+Cu2O↓+3H2O.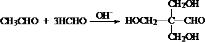 .
.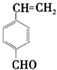 和
和 .
.